Die Carbonylgruppe
C=O neigt aufgrund der positiven Ladung des Kohlenstoffs und der negativen Ladung des Sauerstoffs zu Zusätzen und nukleophilen Angriffen. Die Resonanz der kohlenstoffpartiellen positiven Ladung ermöglicht es der negativen Ladung auf dem Nukleophilen, die Carbonylgruppe anzugreifen und ein Teil der Struktur zu werden, und eine positive Ladung (normalerweise ein Protonenwasserstoff) greift den Sauerstoff an., Nur zur Erinnerung, das Nucleophile ist eine gute Säure und „mag Protonen“, so dass es die Seite mit einer positiven Ladung angreift.
Bevor wir die Reaktivität von Aldehyden und Ketonen im Detail betrachten, müssen wir zurückblicken und uns daran erinnern, wie das Bindungsbild in einem Carbonyl aussieht. Carbonylkohlenstoffe werden sp2 hybridisiert, wobei die drei sp2-Orbitale Soverlaps mit Orbitalen auf dem Sauerstoff und auf den beiden Kohlenstoff-oder Wasserstoffatomen bilden. Diese drei Bindungen nehmen trigonale planare Geometrie an., Das verbleibende unhybridisierte 2p-Orbital auf dem zentralen Carbonylkohlenstoff ist senkrecht zu dieser Ebene und bildet eine „Side-by-Side“ – Pbond mit einem 2p-Orbital auf dem Sauerstoff.
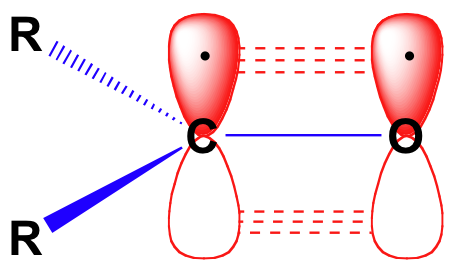
Die Kohlenstoff-Sauerstoff-Doppelbindung ist polar: Sauerstoff ist elektronegativer als Kohlenstoff, daher ist die Elektronendichte auf der Sauerstoffseite der Bindung höher und auf der Kohlenstoffseite niedriger. Denken Sie daran, dass die Bindungspolarität mit einem Dipolpfeil dargestellt werden kann oder indem der Sauerstoff als eine teilweise negative Ladung und der Kohlenstoff als eine teilweise positive Ladung dargestellt wird.,

Eine dritte Möglichkeit, den Kohlenstoff-Sauerstoff-Dipol zu veranschaulichen, besteht darin, die beiden Hauptresonanzfaktoren einer Carbonylgruppe zu betrachten: die Hauptform, die normalerweise in Lewis-Strukturen gezeichnet ist, und einen kleinen, aber sehr wichtigen Beitrag, bei dem beide Elektronen in der Pbond auf dem Sauerstoff lokalisiert sind und ihm eine volle negative Ladung geben. Die letztere Darstellung zeigt den Kohlenstoff mit einem leeren 2p Orbital und einer vollen positiven Ladung.
Schreibe einen Kommentar