Karbonylové Skupiny
C=O je náchylný k doplnění a nucleophillic nebo útoku, protože uhlík má kladný náboj a kyslíku je záporný náboj. Rezonance uhlíku parciální kladný náboj umožňuje negativní náboj na nukleofil k útoku na Karbonylovou skupinu a stát se součástí struktury a pozitivní náboj (obvykle proton vodíku) útoky kyslíku., Jen připomínám, že nukleofil je dobrá kyselina, proto „má rád protony“, takže zaútočí na stranu pozitivním nábojem.
než podrobně zvážíme reaktivitu aldehydů a ketonů, musíme se ohlédnout a připomenout si, jak vypadá obraz lepení v karbonylu. Karbonylkarbony jsou sp2 hybridizovány, přičemž tři SP2 orbitaly tvoří soverlaps s orbitaly na kyslíku a na dvou atomech uhlíku nebo vodíku. Tyto tři vazby přijímají trigonální rovinnou geometrii., Zbývající nehybridizovaný orbital 2P na centrálním karbonylovém uhlíku je kolmý na tuto rovinu a tvoří „bok po boku“ pbond s 2p orbitalem na kyslíku.
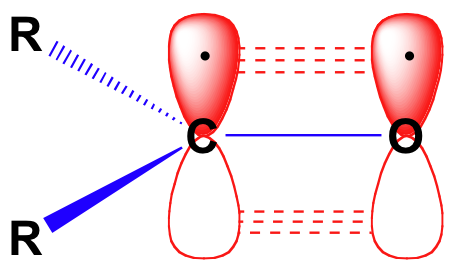
uhlík-kyslík dvojná vazba je polární: kyslík je více elektronegativní než uhlík, takže elektronová hustota je vyšší na straně kyslíku dluhopisů a nižší na uhlíku straně. Připomeňme, že polarita vazby může být zobrazena šipkou dipólu nebo zobrazením kyslíku jako částečného záporného náboje a karbonylového uhlíku částečného kladného náboje.,

třetí způsob, jak ilustrovat uhlík-kyslík dipól je třeba zvážit dva hlavní rezonance přispěvatelé karbonylovou skupinu: hlavní formulář, který je to, co budete obvykle vidět, vypracované v Lewis struktury, a menší, ale velmi důležité přispěvatel, ve kterém se oba elektrony v pbond jsou lokalizovány na kyslík, což je plný negativní náboj. Poslední zobrazení ukazuje uhlík s prázdným 2p orbitalem a plným kladným nábojem.
Napsat komentář