Methoxymethane má stejný molekulární vzorec, stejný počet elektronů, a zhruba stejný tvar a velikost jako ethanol. Navzdory těmto podobnostem se strukturální vzorce (organizace jednotlivých molekul ve vesmíru) liší mezi ethanolem (CH3CH2OH) a methoxymethanem (CH3OCH3). Tento rozdíl v konfiguraci atomů v molekulách má dramatický vliv na volatilitu ethanolu versus methoxymethanu.,
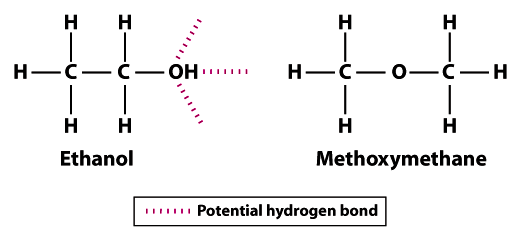 struktury ukazují, proč je ethanol méně těkavý než methoxymethan; ethanol může tvořit tři vodíkové vazby a methoxymethan nemůže tvořit žádné.Všimněte si, že atomy vodíku v methoxymethanu se nemohou účastnit vodíkového spojení se sousedními atomy kyslíku. Atom vodíku hydroxylové skupiny (OH) v ethanolu zvyšuje potenciál vodíkové vazby mezi sousedními molekulami ethanolu. Ve srovnání s methoxymethanem není ethanol zdaleka tak těkavý. Teplota varu 78,5°C pro ethanol je výrazně vyšší ve srovnání s -24.,8°C pro methoxymethan. Tento příklad ilustruje význam pevnosti vazby obecně a vodíkové vazby specificky jako determinant volatility molekuly.
struktury ukazují, proč je ethanol méně těkavý než methoxymethan; ethanol může tvořit tři vodíkové vazby a methoxymethan nemůže tvořit žádné.Všimněte si, že atomy vodíku v methoxymethanu se nemohou účastnit vodíkového spojení se sousedními atomy kyslíku. Atom vodíku hydroxylové skupiny (OH) v ethanolu zvyšuje potenciál vodíkové vazby mezi sousedními molekulami ethanolu. Ve srovnání s methoxymethanem není ethanol zdaleka tak těkavý. Teplota varu 78,5°C pro ethanol je výrazně vyšší ve srovnání s -24.,8°C pro methoxymethan. Tento příklad ilustruje význam pevnosti vazby obecně a vodíkové vazby specificky jako determinant volatility molekuly.
Napsat komentář