podúrovně je energetické úrovni definované dle kvantové teorie.V chemii, podhladiny odkazují na energie spojené s elektrony.Ve fyzice, podhladiny může také se odkazovat na energie spojené s jádrem.,
Niels Bohr nejdříve kvantové teorie, řekl, že elektrony obsadit kulovité skořápky se soustředil na atomové jádro, jako dva elektronové orbitaly uvedené pro lithium níže:
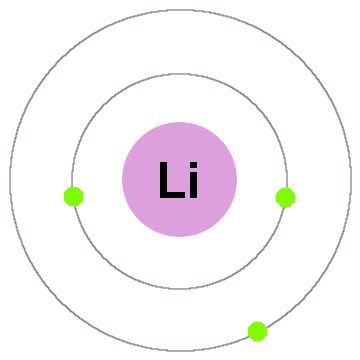
V této staré shell model pohybující se směrem ven.
- Shell 1 může pojmout až 2 elektrony,
- Shell 2 pojme až 8 elektronů,
- Shell 3 může pojmout až 18 elektronů,
- Shell 4 může pojmout až 32 elektronů,
- Shell 5 může pojmout až 50 elektrony…
každá skořápka je ve skutečnosti energetická hladina., Čím vyšší je plášť, tím vyšší je energie jeho elektronů. Všechny elektrony, které sdílejí skořápku, jsou degenerované, což znamená, že mají stejné množství energie.
Pokroky v spektroskopie odhalila, že granáty může ve skutečnosti obsahovat vnořené shelly/podhladiny.Například elektrony ve skořápce 3 mohou mít od sebe různá množství energie, protože zabírají různé podúrovně.
níže uvedený diagram energetické hladiny ukazuje podúrovně tak vysoké, jako je energetická hladina 5F orbitálů.,Podúrovně skutečně pokračují ve vyšších energiích, ale 5f je vhodným místem pro zanechání úvodního popisu.
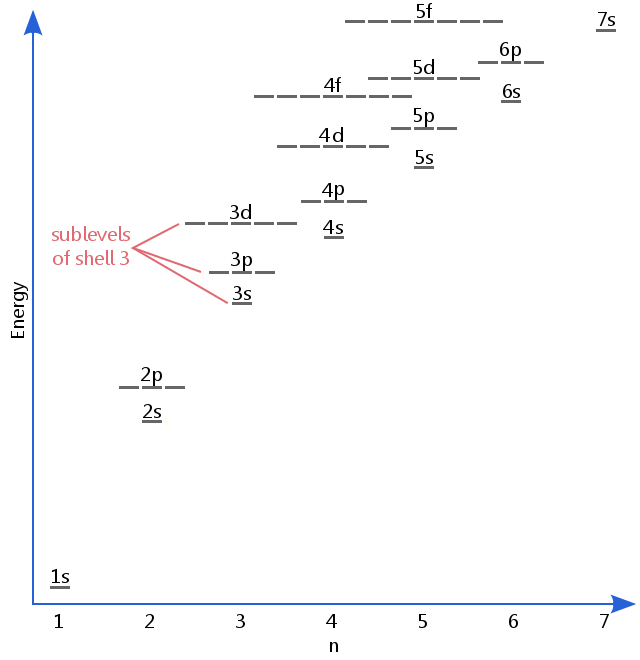

Elektron podhladiny jsou známé tím, že písmena s, p, d a f.Tak, například, elektrony v s mezipatro shell 3 mají různé množství energie z elektronů v p-a d hladina shell 3.(To není případ vodíku., Všechny vodíkové podúrovně mají stejnou energii, protože vodík má pouze jeden elektron.)
s, p, d, a f podúrovně
podúrovně obsazen žádným elektronem je dána elektron má moment hybnosti kvantové číslo, l.,div id=“7de4153d3c“>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
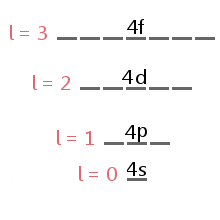
Podúrovně orbitaly mají charakteristické tvary, které mohou být použity vysvětlit a předvídat chemické vazby, že atomy mohou tvořit.Tyto tvary jsou založeny na pravděpodobnosti nalezení elektronu na jakémkoli konkrétním místě obíhajícím kolem jádra.
například, můžeme říci, že elektron v atomu vodíku je 1 podlaží, bude zjištěno, 99% času někde v koule s daným poloměrem kolem jádra.To je důvod, proč můžeme nakreslit orbitaly s jako kouli.,
orbitaly pro vyšší úrovně jsou také kresleny na základě toho, kde jsou s největší pravděpodobností nalezeny elektrony atomu. Viz orbitaly pro více informací.
s mezipatro je orbital
Podúrovně Příkladů
Příklady z podhladiny nalézt v různých atomů jsou uvedeny níže. Horní index ukazuje počet elektronů v každé podúrovni.
Vodík: 1s1,
Uhlík: 1s2 2s2 2p2.
Chlór: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6.
obecně platí, že elektrony jdou do nejnižší dostupné energie podlaží., Obecné pořadí, v jakém podlaží jsou plné, je:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Vzhledem k tomu, můžeme odpovědět na otázky jako: „co draslíku bude elektron podhladiny?“
draslík má 19 elektronů a víme, že s orbitaly drží maximálně dva elektrony a p maximálně šest. Elektronové podúrovně draslíku budou:
Napsat komentář