13 Výroční Léčiv Hlásit
Podívejte se na další funkce článků v tomto měsíci je problém:
Steroid Wars: Nové Drogy Výzvu Staré Zvyky
Úprava Glaukom Režim: Kdy, Proč a Jak
Do & nedělat Orální Léky (CE)
Pro pacienty se suchou oční onemocnění (DED), možnosti léčby byly kdysi omezena na umělé slzy, teplé obklady a občas off-label steroid., Zatímco některé z nich pomáhají uklidnit příznaky, dělají jen málo, aby skutečně zvládly onemocnění, zejména když se zhoršuje. U pacientů, kteří již nejsou léčitelní těmito domácími léky, nový výzkum ukazuje kaskádu objevů v diagnostice i léčbě.
dnes mohou optometristé léčit tyto pacienty topickými a perorálními protizánětlivými léky na předpis, léčbou v místě péče, zahříváním a expresí žláz a dokonce i pokročilými možnostmi, jako jsou amniotické membrány. Zatímco tyto zálohy dávají našim pacientům nový pronájem na oční pohodlí, optometrists mají mnohem více navigovat., Použití nejvhodnější léčby se v rámci optometrických postupů stále velmi liší.3
i když neexistuje jasná shoda ohledně předepisování léků na suché oči, pochopení toho, jak tyto léky fungují, může pomoci lékařům přizpůsobit efektivní řízení pro každého pacienta.
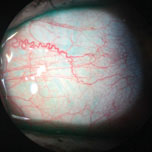
zanícené krevní cévy tohoto pacienta lze vidět bez vitálních barviv. Foto: Vin Dang, OD. Klikněte na obrázek pro zvětšení.,
ztráta homeostázy
pokud jde o léčbu pacientů s DED, včasné a účinné možnosti mohou být komplikovány potřebou přesně detekovat a identifikovat základní etiologie. V roce 2017 společnost Tear Film and Ocular Surface Society (TFOS) vrhla nové světlo na DED se svou druhou zprávou o workshopu Dry Eye (DEWS II). Že výzkum přepracovává DED jako multifaktoriální onemocnění, vyznačující se tím, že ztráta homeostázy slzného filmu a doprovází oční příznaky, které vedou k nestability slzného filmu a důsledku hyperosmolární.,1 Toto obrátilo na hlavu staré paradigma kategorizace DED jako suché oko s nedostatkem vody (ADDE) nebo odpařovací suché oko (EDE). Se závěry DEWS II se již nepovažují za zcela oddělené oční povrchové podmínky, protože vědci zjistili, že až 70% pacientů s DED má smíšené etiologie.2 v popředí této ztráty homeostázy je zánět.,
TFOS ROSA II zprávě se také učil nás „v DED, slza důsledku hyperosmolární je považován nastavit kaskáda signalizační události v povrchových epitelových buněk, které vede k uvolnění zánětlivých mediátorů a proteázy. Tyto mediátory spolu s slzu důsledku hyperosmolární sám, jsou koncipovány tak, aby způsobit pohárkových buněk a epitelových buněk, ztrátu a poškození epitelu glykokalyx. Poškození je posíleno zánětlivými mediátory z aktivovaných T-buněk, které se rekrutují na oční povrch., Čistým výsledkem je charakteristická punctate epiteliopatie DED a nestabilita slzného filmu, která vede v určitém okamžiku k rozpadu filmu brzy. Tento rozpad zhoršuje a zesiluje slznou hyperosmolaritu a doplňuje začarovaný kruh událostí, které vedou k poškození očního povrchu.“1 tento začarovaný zánětlivý kruh je běžnou cestou, kterou vstupují všechny formy DED, bez ohledu na etiologii.
Zánět
Na povrch oka, akutní fáze zánětu výsledky v degranulace žírných buněk a následným uvolněním histaminu a fosfolipidy., Zánětlivé podněty také iniciuje degradaci buněčné membrány prostřednictvím fosfolipázy A2 a následně vede k tvorbě kyseliny arachidonové (AA). Ten je metabolizován 5-lipoxygenázou (LOX) a izoenzymy cyklooxygenázy (COX-1/COX-2), což vede k náboru bílých krvinek a tvorbě prostaglandinů a tromboxanu A2.4,5 prostaglandiny hrají roli v reakci na bolest a zvyšují propustnost cév.,
Jeden z mnoha dopadů této kaskády je produkce a uvolňování zánětlivých cytokinů, jako jsou interleukin-1 (IL-1), tumor nekrotizující faktor-alfa (TNF-a), interleukin-6 (IL-6) a matrix metaloproteinázy (Mmp) u očního povrchu epiteliálních buněk.1,5 To má za následek aktivaci antigen-prezentujících buněk a zvýšené expresi adhezních molekul, jako je intercelulární adhezní molekula-1 (ICAM-1) a selectins do spojivkového cévní endotel.5 to usnadňuje nábor dalších zánětlivých buněk na oční povrch.,
chronický zánět zahrnuje zpracování antigenů buňkami prezentujícími oční antigen a naivními T-buňkami. Primární CD – 4 T-buňky přilnou k aktivovanému vaskulárnímu endotelu a vstupují do oční tkáně. Cytokiny produkované aktivovanými T-buňkami, jako je interferon gama (IFN-Y), zesilují imunitní odpověď zvýšením exprese adhezní molekuly očními cévami.5 metabolity kyseliny arachidonové, jako jsou leukotrieny a prostaglandiny, se aktivně podílejí na vývoji zánětlivého onemocnění.,4
rozpoznání významu a složitosti zánětu v DED nám dává příležitost identifikovat mezery nebo překrytí léčby, pokud můžeme určit, kde každý předpis zapadá podél kaskády.
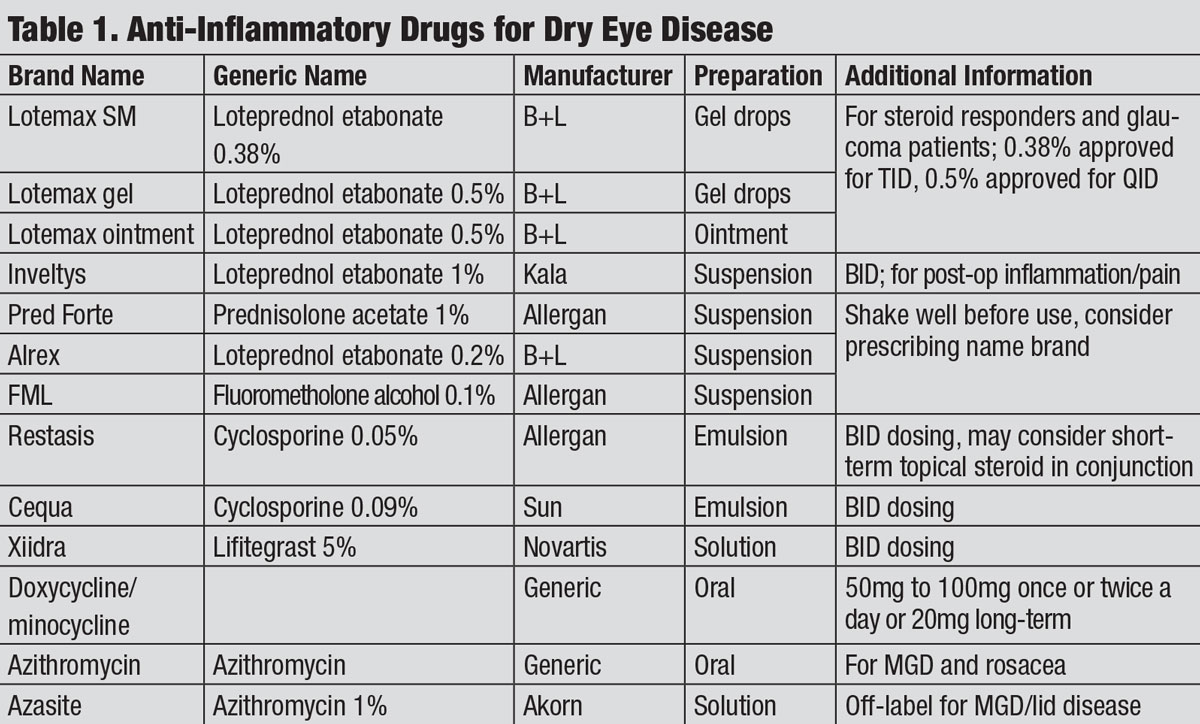
protizánětlivé léky pro suché oční onemocnění. Klikněte na tabulku pro zvětšení.
kortikosteroidy
tyto lokální léky stimulují produkci glykoproteinu zvaného lipokortin., Tvořil lipocortin inhibuje aktivitu fosfolipázy A2, která uvolňuje kyselina arachidonová a v konečném důsledku vede k tvorbě prostaglandinů a tromboxanu A2.6 Steroidy také inhibují tvorbu IL-1, ICAM-1, Mmp a cytokiny.6 Tyto kroky produkují protizánětlivé a imunosupresivní účinky na lokální úrovni jako steroidy blok, oba s LOSOSEM a COX-1/COX-2 dráhy zánětlivé kaskády, snížení vasodilataci, vaskulární permeabilitu a stabilizaci buněčných membrán.,7
klinické studie vykazují významné zlepšení u pacientů se středně těžkou až těžkou ADDE, se zlepšením barvení rohovky a celkovou injekcí.6 výsledkem je, že tyto léky jsou často vysoce účinné krátkodobé protizánětlivé možnosti pro pacienty se zánětem očního povrchu.
výběr nejvhodnějšího kortikosteroidu pro vašeho pacienta vyžaduje znalost mechanismu účinku léku i konkrétního pacienta., Z klinického hlediska má loteprednol řadu očních indikací a také přichází v široké škále formulací, což z něj činí flexibilní volbu pro lékaře.8
nové verze topického podávání léků pro loteprednol také přidává k odvolání. Lotemax SM gel (loteprednol 0.38%, Bausch + Lomb) používá submikronových částic pro zvýšení rozpuštění léku v slzách, což zvyšuje transcorneal penetrace ve srovnání s Lotemax 0.5% gel kapky a umožňuje větší přilnavost k povrchu oka.,9 dále se Lotemax SM zachovává také při nízké dávce benzalkoniumchloridu (BAK) a při dávkování TID, což snižuje zátěž již ohroženého očního povrchu. Pro tohoto stejného důvodu, kromě méně nežádoucích vedlejších účinků (zvýšený nitrooční tlak a subkapsulární katarakta), Lotemax SM je dobrý krátkodobé anti-pobuřující pro pacienty, kteří trpí současně DED a glaukom.
i když není FDA schválen pro řízení DED, byl použit jako off-label léčba pro mnoho pacientů se suchým okem na základě konsensu recenzované odborné literatury.,
Další loteprednol možnost je Inveltys (loteprednol etabonate suspenze 1%, Kala), který se váže loteprednol na hlen-pronikání nanočástic ke zlepšení pronikání a koncentrace léku do oční tkáně.10 konečně, i když ještě nebyl schválen FDA, je další možnost loteprednol, KPI-121 0.25% (loteprednol etabonate suspenze 0.25%, Kala), která by byla speciálně schválena pro příznaky a příznaky DED.11
mimo loteprednol existuje mnoho alternativních možností léčby zánětu očního povrchu, včetně FML (fluormetholonová oftalmická suspenze 0.,25%, 0, 1%, Allergan) nebo Prednisolon acetát 0, 12%. Ty jsou k dispozici v generických formulacích a mohou být účinné při řízení DED, zejména proto, že stojí méně než značkové protějšky.
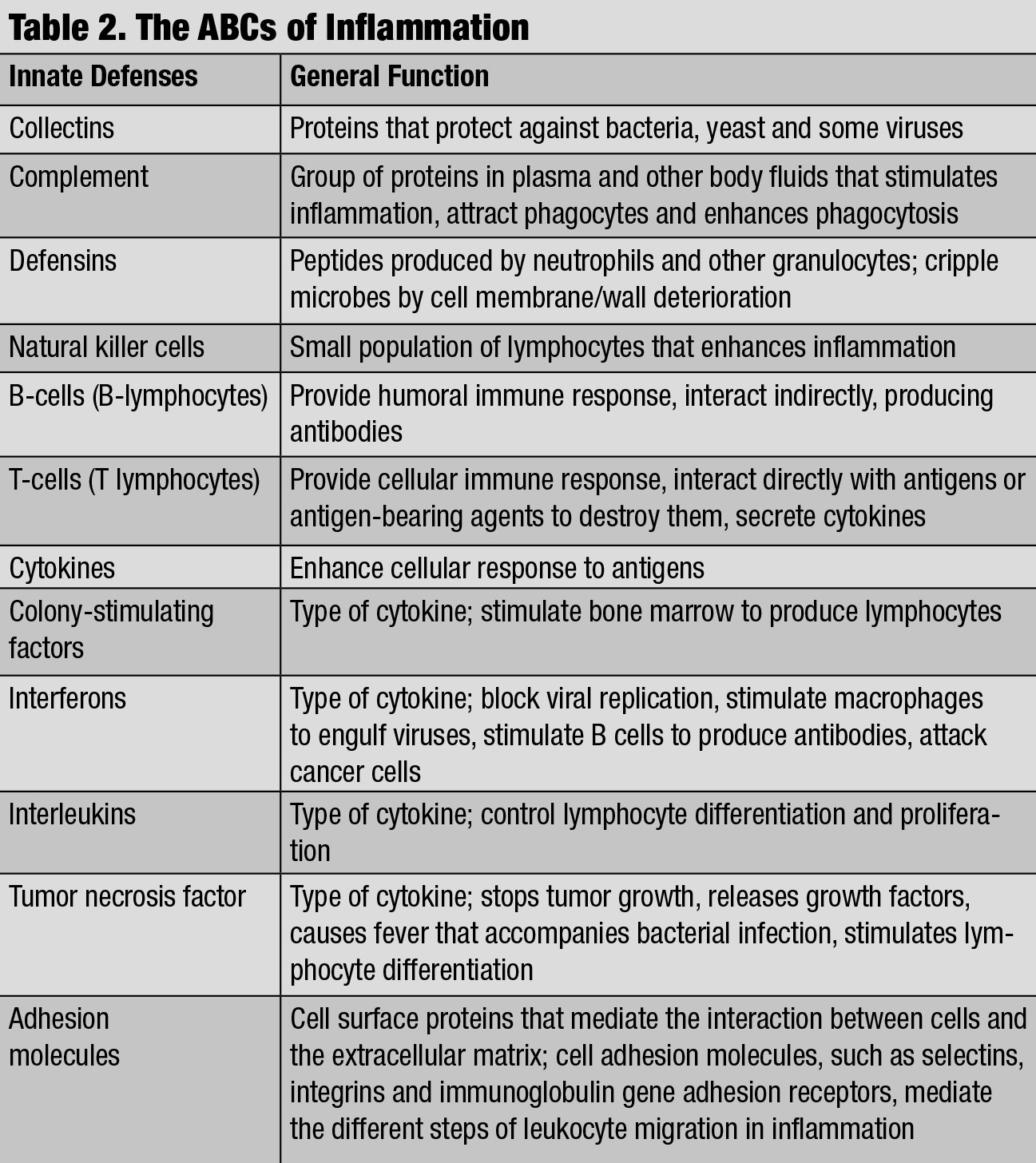
ABC zánětu. Klikněte na tabulku pro zvětšení.
Cyklosporin Imunomodulátory
Restasis (cyklosporin 0.05% emulze, Allergan), je imunomodulátor, který působí na T-buňky v slzného filmu, spojivky a rohovky, a byl k dispozici pro oční použití, od roku 2003.,12 Cyklosporin A (CsA) potlačuje zánět vazbou na proteinový cyklofilin, což nakonec vede ke snížení formulace interleukinu-2 (IL-2) a potlačení aktivace T-buněk. lL – 2 je vylučován t-pomocnými buňkami a stimuluje proliferaci cytotoxických T-buněk a dalších T-pomocných buněk.12,13
protože CsA zastavuje další aktivaci T-buněk, ale necílí se na již aktivní T-buňky, nemusí dojít k okamžitému zlepšení DED příznaků. Z tohoto důvodu lékaři často předepisují krátkou dávku kortikosteroidů po zahájení Restázy., Další zdroj nedodržení pacienta vyplývá z vozidla dodávky léků. CsA 0,05% vyžaduje suspenzi v emulgačním činidle, jako je glycerin nebo ricinový olej, protože má sama o sobě špatnou rozpustnost ve vodě. Tato suspenze přispívá k některým vedlejším účinkům, jako je pálení a hyperemie.13
Cequa (cyklosporin 0,09% oční roztok, sluneční Oftalmika) byl schválen FDA v roce 2018 a nedávno vstoupil na oční trh.14 dávkování s nanomicelární technologií (Ncell, Sun Oftalmics) se snaží vyhnout problémům s rozpustností u CsA 0.,05%, Cequa si klade za cíl poskytnout oko s nejvyšší koncentrací CsA na trhu.14 Nanomicel má hydrofilní i hydrofobní vlastnosti, což zvyšuje jejich schopnost účinně proniknout do očního epitelu s minimálním podrážděním nebo degradací léčiva.14 S podobným vedlejším účinkem profil Restasis, to bude muset být vidět, jak pacienta, dodržování reaguje na vyšší úrovni koncentrace cyklosporinu a pokud je současné užívání steroidů bude nezbytné pro účinnou úlevu od příznaků.,
Ostatní Imunomodulátory
Xiidra (lifitegrast oční roztok 5%, Novartis) vstoupila na trh v roce 2016 a je v současné době jedinou schválenou léčbou pro obě známky a příznaky DED.15 podobně jako cyklosporin, Xiidra také inhibuje zánětlivou cestu zprostředkovanou T-buňkami tím, že zabraňuje náboru a aktivaci na oční povrch. Xiidra však působí tak, že blokuje interakci mezi antigenem 1 spojeným s funkcí lymfocytů (LFA-1) a intercelulární adhezní molekulou 1 (ICAM-1).,16
Blokování této interakce LFA-1on T-buněk a ICAM-1 se snižuje aktivace T-buněk a migraci z cév na povrchu oka, stejně jako sekreci více pro-zánětlivých cytokinů (například IL-1, TNF-a, IFN-Y), snížení zánětu.17 klinických studií přípravku lifitegrast prokázalo statisticky významné zlepšení příznaků a příznaků DED.17 při dávkování bez konzervačních látek jsou nejčastějšími vedlejšími účinky pálení, rozmazání při instilaci a dysgeusie., Z hlediska farmakologie, zánětlivé mediátory, jsou stále přítomny na povrchu oka, když Xiidra je zahájeno, a steroidy, může ještě být použity ke zvýšení pohodlí pacienta. Jak již bylo řečeno, mnoho pacientů je úspěšně léčeno přípravkem Xiidra jako první nebo samostatná léčba.
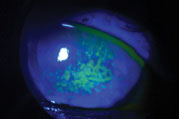
barvení fluoresceinem sodným ukazuje, že povrch rohovky tohoto pacienta je ohrožen onemocněním suchého oka. Foto: Vin Dang, OD. Klikněte na obrázek pro zvětšení.
antibiotika
perorální tetracyklin a tetracyklinové deriváty (např.,, doxycyklin, minocyklin) lze použít k léčbě onemocnění souvisejících s DED, jako je rosacea, blefaritida a dysfunkce Meibomových žláz. Tato širokospektrá antibiotika regulují lipidy a inhibují syntézu bakteriálních proteinů kromě protizánětlivých vlastností.2 Výzkum ukazuje, že může snížit MMP a fosfolipázy A2 aktivity, stejně jako snížení produkce zánětlivých mediátorů, jako je IL-1 a TNF-a, což vede ke snížení podráždění a lepší stabilitu slzného filmu.,2 Tyto vlastnosti z nich činí atraktivní volbu pro krátkodobé zvládnutí očního zánětu nebo dlouhodobě při nižší dávce s minimálními vedlejšími účinky.2
Další možností léčby antibiotiky je perorální azithromycin, protože protizánětlivé vlastnosti pomáhají kontrolovat jak zánět víka, tak inhibici prozánětlivých cytokinů a bakteriální flóry.2,18 zatímco neexistuje univerzální dohoda o dávkování, kratší průběh léčby pomocí 250 mg až 500 mg po dobu pěti dnů může být účinný při léčbě růžovky.,18 pokud jde o rozhodnutí o předepisování perorální léčby, zvažte azithromycin jako počáteční možnost, pokud není kontraindikováno jinak. Studii vydala v roce 2019 prokázáno, že ústní azithromycin účinnost byla vynikající ústní doxycyklin pro léčbu meibomovy žlázy dysfunkce při zvažování, dávkování a dobu trvání.19
Azasite (azithromycin oční roztok 1%, Akorn) byl schválen FDA pro bakteriální zánět spojivek, ale byl dobře tolerován pro off-label léčbu meibomovy žlázy dysfunkce a EDE., Kromě snížení zánětlivých mediátorů a potlačení prozánětlivých mediátorů, výzkum ukazuje, že aktuální azithromycin může zlepšit lipidový chování meibomovy žlázy sekrety.20 žádný výzkum dosud neprokazuje žádný přínos pro kombinaci systémových a topických antibiotik ke zlepšení léčby DED.
jak ukazuje nedávný výzkum, DED je složitý a náročný. Než to ODs začne zvládat, vyžaduje jasné diagnostické pochopení očního povrchu jednotlivých pacientů., To znamená identifikaci souběžných očních stavů a systémových faktorů, které mohou zhoršit onemocnění.
při určování léčby musí lékaři zvážit osmolaritu, zánět, historii léčby a barvení očního povrchu. Jak již bylo řečeno, pomocí těchto indikátorů by optometristé měli předepisovat terapii suchým okem, která zahrnuje specifické cílení podél zánětlivé kaskády, zejména na počátku prezentace onemocnění. Kromě toho může přístup k léčbě a řízení s flexibilitou sloužit těmto pacientům více v dlouhodobém horizontu., I když off-label možnosti, zvážit TID nebo QID Čsa dávkování, předepisování souběžné anti-pobuřující léčby, jako jsou oba Restasis a Xiidra, nebo Čsa léčby spolu s orální antibiotika, aby se účinně léčit a spravovat pacienta známky a příznaky. Použití více terapií a modalit k řešení příznaků brzy může poskytnout tuto další výhodu.
v konečném důsledku je nezbytné vzdělávat pacienty a zdůrazňovat význam celoživotního řízení pro DED., Budou dobré dny a špatné dny, stejně jako lepší a horší období DED a modifikace řízení nejsou vždy neúspěchy v průběhu onemocnění.
Dr. Grant je klinický instruktor na Southern College of Optometry v Memphisu, Tenn.
Napsat komentář