Tlak a KMT
makroskopické jevy tlaku mohou být vysvětleny z hlediska molekulární kinetické teorie plynů. Předpokládejme případ, kdy je molekula plynu (reprezentovaná sférou) v krabici, délka L (Obrázek 1). Pomocí předpoklady stanovené výše, a vzhledem k tomu, koule se pohybuje pouze v x-směru, můžeme zkoumat například z oblasti kolize elasticky s jednou ze stěn krabice.,
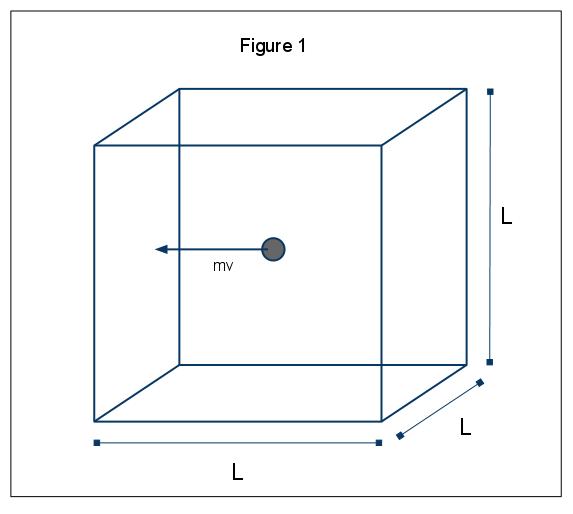
hybnost této kolize je dána vztahem p=mv, v tomto případě p=mvx, protože jsme pouze s ohledem na x rozměr. Celková změna hybnosti za tuto kolizi je pak dána tím,
\
Vzhledem k tomu, že množství času to bere mezi srážky molekul se stěnou je L/vx můžeme dát frekvenci srážek molekul proti dané stěny krabice za jednotku času, jako vx/2L., Nyní lze vyřešit změnu hybnosti za jednotku času:
\
řešení pro hybnost za jednotku času dává sílu vyvíjenou objektem (F=ma=p/čas)., S výrazem, že F=mvx2/L lze nyní vyřešit pro tlak vyvíjený molekulární kolize, kde oblast je uvedena jako oblast jedné stěně krabice, A=L2:
\
\
výraz, mohou být zapsány, pokud jde o tlak spojený s kolizí od N počet molekul:
\
Tento výraz může nyní být upravena tak, aby účet pro pohyb v osách x, y a z směrech pomocí mean-square velocity pro tři rozměry a velké hodnoty N., Výraz je nyní napsán jako:
\
tento výraz nyní dává tlak, makroskopickou kvalitu, pokud jde o atomový pohyb. Význam výše uvedeného vztahu spočívá v tom, že tlak je úměrný střední čtvercové rychlosti molekul v dané nádobě. Proto, jak se zvyšuje molekulární rychlost, tak i tlak vyvíjený na nádobu.
Napsat komentář