nedlouho poté, G. N. Lewis popularizoval elektron-dot model, kvantová mechanika se stal velmi výkonný model, včetně jeho použití k popisu chemické vazby. Dva modely-model valenční vazby a molekulární orbitální model-byly vyvinuty téměř současně. Linus Pauling se stal šampiónem modelu Valence bond, který je snadněji vizualizovatelný a použitelný. Tento model je v podstatě kvantová mechanická verze modelu electron-dot: pokouší se popsat, jaké orbitaly používají každý atom, když jsou elektrony sdíleny., Například, kdy se jednoduchá molekula H2 je tvořen z atomů vodíku, valence bond model říká, že s-orbital na jeden atom překrývá s s-orbital na druhou tvořit pouto. To je někdy znázorněno překrývacím diagramem a obrázkem, jak je znázorněno na obrázku 30.

obrázek 30. Překrytí diagram a obrázek pro popis valenční vazby diatomického vodíku.,
jeden z problémů, s nimiž se Pauling setkal brzy ve svém průkopnickém úsilí s teorií valence bond, je jasně ilustrován jednoduchým obrazem valenční vazby lepení ve vodě. Obrázek 31 ukazuje dva P-orbitaly na kyslíku překrývající se s-orbitaly na vodících. Tento obrázek jasně ukazuje, že bond úhel ve vodě by měl být 90°, protože dva p-orbitaly jsou zarovnány podél os x a y, a proto jsou kolmé.

obrázek 31. Orbitální překrytí ve vodě.,
úhel vazby ve vodě je ve skutečnosti 105°, což je významný odklon od 90°. Tento druh chyb, nemusí zdát významný, ale pro někoho, kdo se snaží formulovat model, který bude vysvětlovat, jak moc určité části přírody, jak je to možné, tento rozdíl mezi teorií a experimentální skutečnosti je velmi obtížný. Pauling pak přidal další modifikaci teorie-hybridizaci., Pauling řekl, že atomové orbitaly v atomu nejsou nedotknutelné, jsou jen jedním z možných sadu matematických rovnic (pamatujete si na náš rozhovor vlny model), které mohou být použity k popisu elektronů v atomu. Další sady mohou být generovány přidáním a odečtením těchto atomových orbitálů podle určitých pravidel. Tedy, pokud s orbital a tři p-orbitaly jsou v kombinaci matematicky, nová sada orbitaly sp3 orbitaly, jsou generovány. Nová sada orbitalů má odlišné orientační charakteristiky než soubor atomových orbitalů., Obrázek 32 ukazuje s a tři P-orbitaly v části a) a poté v části b) čtyři nové hybridy sp3. Jak vidíte, tyto hybridy sp3 jsou orientovány směrem k rohům čtyřstěnu. Obrázek 33 ukazuje, že tyto hybridy se používají k popisu lepení ve vodě. Protože úhel mezi hybridy je 109°, nyní očekáváme, že úhel vazby ve vodě bude 109°. Je zřejmé, že nám to dává lepší souhlas s experimentální hodnotou 105°. (Všimněte si, že to není v dokonalé dohodě, ale je to nejlepší, co můžeme udělat.,) Jsou také možné další hybridizační kombinace, které jsou shrnuty na obrázku 34.

obrázek 32. SP3 hybridizace.
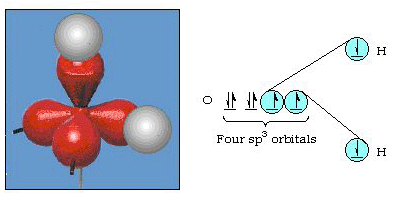
obrázek 33. Použití hybridů sp3 k vysvětlení úhlu vazby ve vodě.
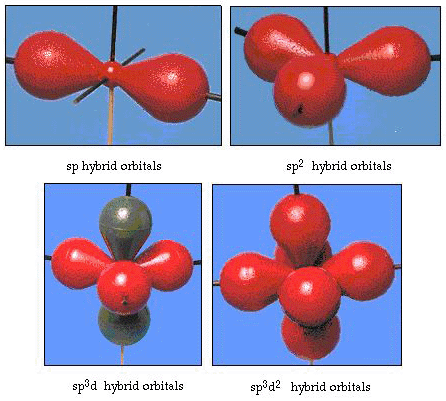
obrázek 34. Další hybridizační schémata.
press for video
existuje ještě jedna funkce modelu Valence bond, která si zaslouží diskusi. Dobře to ilustruje naše známá molekula kyslíku, O2., Obrázek 35 ukazuje překrytí dvou px-orbitalů, které nám dávají jednu vazbu. Máme-li dodržovat pravidlo oktetu, musíme také vytvořit další pouto. To musí být překrytím dvou PY nebo dvou Pz orbitálů (nezáleží na tom, které). Tato vazba má svou elektronovou hustotu nad a pod internukleární linií, spíše než přímo mezi dvěma jádry kyslíku. Tato vazba je označována jako 1-vazba, zatímco ta, která dává elektronovou hustotu mezi atomy, se nazývá Sigma (σ) vazba., Jedním ze zajímavých důsledků tohoto obrázku je, že 1-bond se předpokládá, že bude slabší než sigma-bond (překrytí orbitalů je slabší). To znamená, že dvojitá vazba nemá sílu dvou jednotlivých vazeb a je také náchylnější k útoku vnějšími atomy, které hledají elektronovou hustotu.

obrázek 35. Tvorba Sigma a Pi vazeb v diatomickém kyslíku.,
jako konečný příklad valenční vazby lepení, obrázek 36 ukazuje obraz orbitalů zapojených do vazby v ethenu, nejjednodušší nenasycený uhlovodík (H2C=CH2). Experimentálně bylo prokázáno, že úhly vazby kolem každého uhlíku jsou téměř 120°. Náš obrázek tedy ukazuje použití hybridů sp2 (protože mají 120° úhly mezi sebou) pro konstrukci vazeb sigma. 1-vazba je tvořena překrytím dvou Pz orbitalů. Je důležité si uvědomit, že 1-vazba představuje bariéru rotace kolem vazby uhlík-uhlík., To znamená, že pokud by se jedna skupina CH2 měla otáčet, musela by být 1-vazba přerušena, což by vyžadovalo značnou energii. Důsledkem toho je, že 1-vazba fixuje dvě skupiny CH2 v jedné rovině, což způsobuje, že celková molekula je rovinná.

obrázek 36. Spojení v ethenu.
molekulární orbitální model má jiný přístup. Využívá všechny orbitaly na všech atomech k vytvoření souboru orbitalů, které se rozprostírají nad všemi atomy na celé molekule., Molekulární orbitální model je obtížnější vizualizovat, ale je také silnější. Obtížný proces určování, jak kombinovat atomové body za účelem generování molekulárních orbitalů, se nyní provádí počítačem i pro velké molekuly. Praktikující chemik používá molekulární orbitální model k predikci spekter, přechodových stavů atd., ale pro každodenní chemické diskuse stále vládnou modely elektronových teček a valenčních vazeb.
Napsat komentář