Cíl Učení
- Diskutujte vlastnosti dusíku.
klíčové body
- dusík je chemický prvek se symbolem N A atomovým číslem 7. Elementární dusík je bezbarvý, bez zápachu, bez chuti, a většinou inertní dvouatomová molekula plynu za standardních podmínek, které tvoří 78.09% Zemské atmosféry objemových.,
- Dusík je průmyslový plyn vyrábí frakční destilací kapalného vzduchu nebo mechanicky pomocí plynného vzduchu. Komerční dusík je často vedlejším produktem zpracování vzduchu pro průmyslovou koncentraci kyslíku.
- dusíkatý plyn má řadu aplikací, včetně podávání jako inertní náhrada vzduchu, kde je oxidace nežádoucí. Kapalný dusík se také používá k kryogennímu zmrazení objektů.
termíny
- elementalOf, vztahující se nebo být prvkem (na rozdíl od sloučeniny).,
- aminokyselinaobecně, molekuly, které obsahují jak aminokyselinu, tak karboxylovou funkční skupinu. Monomery, ze kterých jsou postaveny polypeptidové řetězce nebo proteiny, jsou aminokyseliny.
- chemický prvek nitrogenA (symbol N) s atomovým číslem 7 a atomovou hmotností 14.0067 amu.
prvek dusík byl objeven jako oddělitelná složka vzduchu skotským lékařem Danielem Rutherfordem v roce 1772. Sloučeniny dusíku byly ve středověku dobře známy. Alchymisté znali kyselinu dusičnou jako aqua fortis (silná voda)., Směs kyseliny dusičné a kyseliny chlorovodíkové byla známá jako aqua regia (Královská voda), oslavovaná svou schopností rozpouštět zlato (Král kovů). Nejstarší vojenské, průmyslové a zemědělské aplikace dusíkatých sloučenin, které se používají ledek (dusičnan sodný nebo draselný), zejména střelný prach a později jako hnojivo.
dusík je chemický prvek se symbolem N A atomovým číslem 7. Elementární dusík je bezbarvý, bez zápachu, bez chuti, a většinou inertní dvouatomová molekula plynu za standardních podmínek, které tvoří 78.09% Zemské atmosféry objemových., Dusík je společný prvek ve vesmíru, odhadovaný na přibližně sedmou celkovou hojnost v naší galaxii a sluneční soustavě. Předpokládá se, že jeho výskyt je zcela způsoben syntézou fúzí uhlíku a vodíku v supernovách. Vzhledem k volatilitě elementárního dusíku a jeho sloučenin s vodíkem a kyslíkem je dusík mnohem méně běžný na skalnatých planetách vnitřní sluneční soustavy a je relativně vzácným prvkem na Zemi. Nicméně, stejně jako na Zemi, dusík a jeho sloučeniny se vyskytují běžně jako plyny v atmosféře planet a měsíců.,
dusík v živých systémech
dusík se vyskytuje ve všech živých organismech, především v aminokyselinách, které tvoří proteiny, a nukleových kyselinách (DNA a RNA). Lidské tělo je asi tři procenta dusíku, čtvrtý nejhojnější prvek po kyslíku, uhlíku a vodíku. Dusíku spočívá v chemické struktuře téměř všech neurotransmiterů a je rozhodující složkou alkaloidy, biologické molekuly produkované jako sekundární metabolity mnoha organismů.,
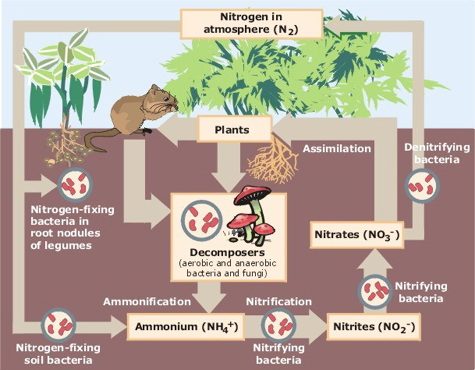
koloběh dusíku popisuje pohyb prvku ze vzduchu do biosféry a organických sloučenin a zpět do atmosféry. Synteticky vyráběné dusičnany jsou klíčovými složkami průmyslových hnojiv a klíčových znečišťujících látek způsobujících eutrofizaci vodních systémů.
Průmyslová Výroba Dusíku
Dusík je průmyslový plyn vyrábí frakční destilací kapalného vzduchu nebo mechanicky pomocí plynného vzduchu (tj. tlakovou membránu reverzní osmózy nebo pressure swing adsorption). Komerční dusík je často vedlejším produktem zpracování vzduchu pro průmyslovou koncentraci kyslíku pro ocelářství a jiné účely. Když je dodáván stlačený ve válcích, často se nazývá OFN (dusík bez kyslíku).,
V chemické laboratoři připravuje se působením vodného roztoku chloridu amonného s dusitan sodný, nebo prostřednictvím rozkladu azid sodný:
NH_4Cl (aq) + NaNO_2 (aq) \rightarrow N_2 (g) + NaCl (aq) + 2 H_2O (l)2 NaN_3 \rightarrow 2 Na + 3 N_2
Chemické Vlastnosti Dusíku
Dusík je nekov s elektronegativita 3,04. Má pět elektronů ve svém vnějším plášti, a proto je ve většině sloučenin trojmocný. Trojná vazba v molekulárním dusíku (N2) Je jednou z nejsilnějších známých., Výsledná obtížnost přeměny N2 na jiné sloučeniny a snadnost (a související vysoké uvolňování energie) přeměny dusíkatých sloučenin na elementární N2 dominovaly roli dusíku jak v přírodě, tak v lidské ekonomické činnosti.
Dusíku Emisní Spektra
Molekulární dusík (14N2) je do značné míry transparentní pro infračervené a viditelné záření, protože to je homonuclear molekuly, a proto nemá žádný dipólový moment, aby pár elektromagnetické záření na těchto vlnových délkách., Významná absorpce nastává při extrémních ultrafialových vlnových délkách, počínaje vlnovou délkou kolem 100 nanometrů. To je spojeno s elektronickými přechody v molekule, aby státy, v nichž obvinění není rozložena rovnoměrně mezi atomy dusíku. Absorpce dusíku vede k významné absorpci ultrafialového záření v horní atmosféře Země a atmosféře jiných planetárních těles.

Dusík je také používán při přípravě vzorků pro chemickou analýzu se soustředit a snížit objem kapalných vzorků., Směrování přetlakového proudu plynného dusíku kolmo k povrchu kapaliny umožňuje odpaření rozpouštědla při ponechání rozpuštěné látky(látek) a nerovnoměrného rozpouštědla za sebou. Dusíkové nádrže také nahrazují oxid uhličitý jako hlavní zdroj energie pro paintballové zbraně. Dusík však musí být udržován při vyšším tlaku než CO2, což činí nádrže N2 těžší a dražší.
Napsat komentář