carbonylgruppen
c=o er tilbøjelig til Tilføjelser og nukleofil angreb, fordi eller carbon ‘ s positive ladning og O .ygens negative ladning. Resonansen af den carbon partielle positive ladning tillader den negative ladning på nukleofilen at angribe carbonylgruppen og blive en del af strukturen, og en positiv ladning (normalt et protonhydrogen) angriber iltet., Bare en påmindelse, nukleofilen er en god syre, derfor “kan lide protoner”, så den vil angribe siden med en positiv ladning.
før vi i detaljer overvejer reaktiviteten af aldehyder og ketoner, skal vi se tilbage og minde os om, hvordan bindingsbilledet ser ud i en carbonyl. Carbonyl carbons er SP2 hybridiseret, med de tre sp2 orbitaler danner soverlaps med orbitaler på O .ygen og på de to carbon eller hydrogenatomer. Disse tre obligationer vedtager trigonal plan geometri., Det resterende uhybridiserede 2p-orbital på det centrale carbonylcarbon er vinkelret på dette plan og danner en ‘side om side’ pbond med en 2p-orbital på O .ygenet.
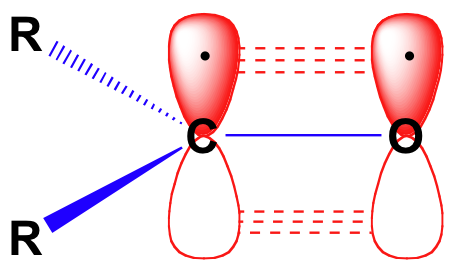
kulstof og ilt dobbeltbinding er polar: ilt er mere elektronegative end kul, så elektron densitet er højere på ilt side af bond og lavere om carbon side. Husk, at bindingspolaritet kan afbildes med en dipolpil, eller ved at vise o .ygenet som at holde en delvis negativ ladning og carbonylcarbon en delvis positiv ladning.,

En tredje måde til at illustrere, at det kulstof, ilt dipol er at betragte de to vigtigste resonans bidragydere af en carbonyl-gruppen: den store form, hvilket er, hvad du typisk se tegnet i Lewis-strukturer, og en mindre, men meget vigtig bidragyder, hvor både elektroner i pbond er lokaliseret på ilt, giver det en fuld negativ ladning. Sidstnævnte skildring viser carbon med en tom 2P orbital og en fuld positiv ladning.
Skriv et svar