et underniveau er et energiniveau defineret af quantumuantum theory.In Kemi, underniveauer henviser til energier forbundet med electrons.In fysik, underniveauer kan også henvise til energier forbundet med kernen.,
Niels Bohr ‘ s tidligste quantum teori sagde, at elektroner besætte kugleformede skaller, der er centreret om atomkerner, som de to elektron skaller, der er vist for lithium nedenfor:
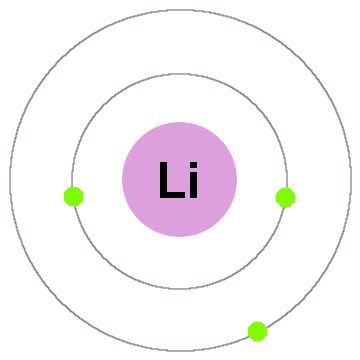
I denne gamle shell-modellen bevæger sig udad:
- Shell 1 kan rumme op til 2 elektroner,
- Shell 2 kan rumme op til 8 elektroner,
- Shell 3 kan holde i op til 18 elektroner,
- Shell 4 kan indeholde op til 32 elektroner,
- Shell 5 kan indeholde op til 50 elektroner,…
hver skal er faktisk et energiniveau., Jo højere skallen er, desto højere er energien af dens elektron(er). Alle elektroner, der deler en skal, er degenererede, hvilket betyder, at de har den samme mængde energi.
fremskridt inden for spektroskopi afslørede, at skaller faktisk kan indeholde subshells / sublevels.Elektronerne i shell 3 kan for eksempel have forskellige mængder energi fra hinanden, fordi de besætter forskellige underniveauer.
energiniveaudiagrammet nedenfor viser underniveauer til så højt som energiniveauet for 5f-orbitalerne.,Underniveauer fortsætter faktisk med højere energier end dette, men 5f er et passende sted at forlade en indledende beskrivelse.
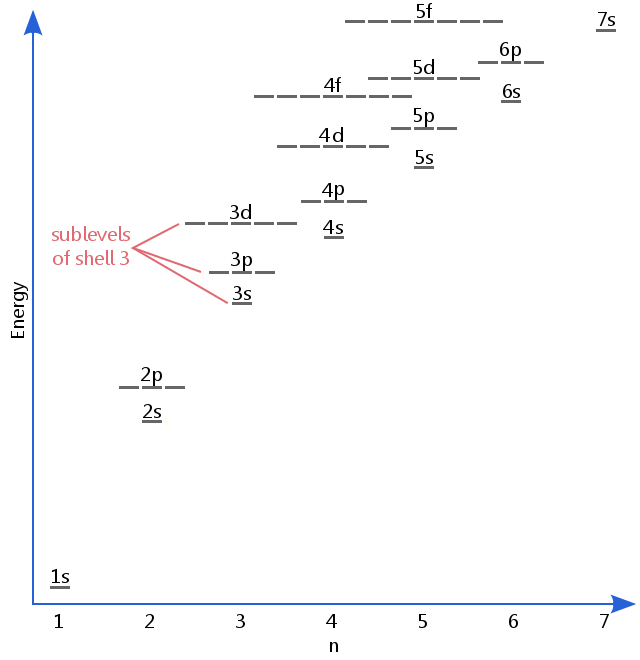

Elektron underniveauer, er kendt af de breve, s, p, d, og f.Så, for eksempel, elektroner i s underniveau af skallen 3 har en forskellig mængde af energi fra elektroner i p og u-niveauer af shell-3.(Dette er ikke tilfældet for brint., Alle hydrogens underniveauer har den samme energi, fordi hydrogen kun har en elektron.)
S, P, D og f underniveauer
underniveauet optaget af en hvilken som helst elektron bestemmes af elektronens vinkelmomentkvantetal, l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
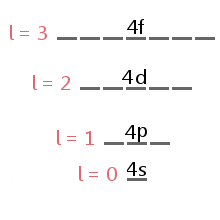
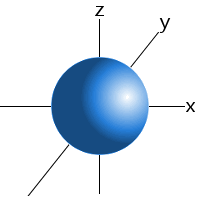
Sublevel orbitaler har karakteristiske former, der kan bruges til at forklare og forudsige de kemiske bindinger, som atomer kan danne.Disse former er baseret på sandsynligheden for at finde en elektron på et bestemt sted, der kredser om kernen.
for eksempel kan vi sige, at en elektron i et hydrogenatom 1s underniveau vil blive fundet 99 procent af tiden et sted i en kugle med en given radius omkring kernen.Dette er grunden til, at vi kan tegne s sublevels orbitaler som en kugle.,
orbitaler for højere underniveauer tegnes også på grundlag af hvor et atoms elektroner mest sandsynligt findes. Se orbitaler for flere detaljer.
An S sublevel ‘ s orbital
Sublevel eksempler
eksempler på de underniveauer, der findes i forskellige atomer, er vist nedenfor. Superskriptet viser antallet af elektroner i hver underniveau.
Hydrogen: 1s1
Kulstof: 1s2 2s2 2p2
Chlor: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
I almindelighed, elektroner gå ind i den lavest mulige energi underniveau., Den almindelige rækkefølge, som underniveauer, der er fyldt op er:
1s 2s 2p 3s 3p 4s 3d-4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
i Betragtning af dette, vi kan besvare spørgsmål som: “hvad er kalium er electron underniveauer?”
kalium har 19 elektroner, og vi ved, at s-orbitaler højst har to elektroner og p højst seks. Kaliums elektronunderniveauer vil være:
Skriv et svar