Ikke længe efter G. N. Lewis populariseret elektron-dot model, kvantemekanik blev en meget kraftig model, herunder dens anvendelse til at beskrive den kemiske binding. To modeller-valence bond model og den molekylære orbital model – blev udviklet næsten samtidigt. Linus Pauling blev mester for valence bond-modellen, som er lettere at visualisere og bruge. Denne model er i det væsentlige en kvantemekanisk version af elektron-dot-modellen: den forsøger at beskrive, hvilke orbitaler der bruges af hvert atom, når elektroner deles., For eksempel, når det enkle molekyle H2 dannes af hydrogenatomer, siger valensbindingsmodellen, at en s-orbital på et atom overlapper med en s-orbital på den anden for at danne en binding. Dette er undertiden afbildet af et overlapningsdiagram og et billede som vist i figur 30.

Figur 30. Overlap diagram og billede for Valence bond beskrivelse af diatomisk hydrogen.,
et af de problemer, som Pauling stødte tidligt i sin banebrydende indsats med valence bond-teori, er tydeligt eksemplificeret ved et simpelt valence bond-billede af bindingen i vand. Figur 31 viser to p-orbitaler på ilt, der overlapper med s-orbitaler på hydrogener. Dette billede viser tydeligt, at bindingsvinklen i vand skal være 90., fordi de to p-orbitaler er rettet ind langs axes-og y-akserne og derfor er vinkelrette.

Figur 31. Orbital overlapning i vand.,
faktisk er bindingsvinklen i vand 105., en betydelig afvigelse fra 90.. Denne form for fejl synes måske ikke at være vigtig for dig, men for nogen, der forsøger at formulere en model, der vil forklare så meget af en bestemt del af naturen som muligt, er denne forskel mellem teori og eksperimentel kendsgerning meget generende. Pauling tilføjede derefter en anden ændring til teorien-hybridisering., Pauling sagde, at atomare orbitaler på et atom ikke er ukrænkelige, de er kun et muligt sæt matematiske ligninger (husk vores diskussion af bølgemodellen), der kan bruges til at beskrive elektronerne i det atom. Andre sæt kan genereres ved at tilføje og subtrahere disse atomare orbitaler i henhold til visse regler. Således, hvis en s orbitale og de tre p-orbitaler kombineres matematisk, genereres et nyt sæt orbitaler, sp3 orbitaler. Det nye sæt orbitaler har forskellige orienteringsegenskaber end sæt atomare orbitaler., Figur 32 viser S og tre p-orbitaler i del (A) og derefter i del (b) de fire nye sp3 hybrider. Som du kan se, er disse SP3-hybrider orienteret mod hjørnerne af en tetrahedron. Figur 33 viser, at disse hybrider anvendes til at beskrive bindingen i vand. Fordi vinklen mellem hybriderne er 109., forventer vi nu, at bindingsvinklen i vand er 109.. Det er klart, at dette giver os bedre enighed med den eksperimentelle værdi på 105.. (Bemærk, at dette ikke er i perfekt enighed, men det er det bedste, vi kan gøre.,) Andre hybridiseringskombinationer er også mulige, og disse er opsummeret i figur 34.

Figur 32. SP3 hybridisering.
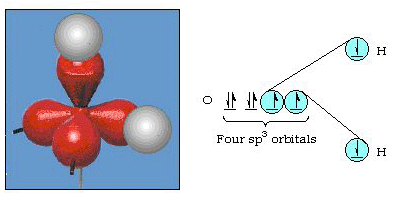
Figur 33. Brug af sp3 hybrider til at forklare bindingsvinklen i vand.
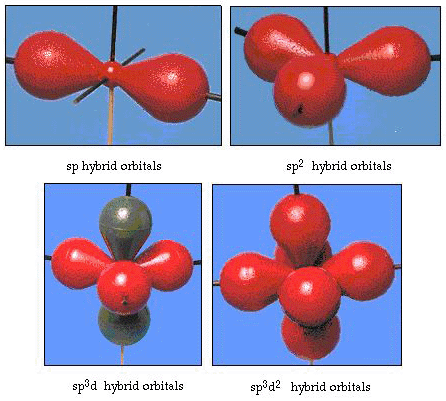
Figur 34. Andre hybridiseringsordninger.
tryk for video
Der er et andet træk ved valence bond-modellen, som fortjener diskussion. Det illustreres pænt af vores velkendte iltmolekyle, O2., Figur 35 viser overlapningen af to p. – orbitaler for at give os en enkelt binding. Hvis vi skal adlyde oktetreglen, må vi også danne et andet bånd. Dette skal ske ved overlapning af to py eller to p.orbitaler (det betyder ikke noget, hvilket). Denne binding har sin elektrondensitet over og under den internukleære linje snarere end direkte mellem de to iltkerner. Denne binding omtales som en 1-binding, mens den, der sætter elektrondensitet mellem atomerne kaldes en sigma ()) binding., En af de interessante konsekvenser af dette billede er, at 1-bindingen forventes at være svagere end sigma-bindingen (overlapningen af orbitalerne er svagere). Dette betyder, at en dobbeltbinding ikke har styrken af to enkeltbindinger og også er mere modtagelig for angreb fra eksterne atomer, der søger efter elektrondensitet.

Figur 35. Dannelse af Sigma og pi bindinger i diatomisk ilt.,
som et sidste eksempel på valensbindingsbehandlingen af binding viser figur 36 et billede af de orbitaler, der er involveret i bindingen i ethen, det enkleste umættede carbonhydrid (H2C=CH2). Eksperimentelt har det vist sig, at bindingsvinklerne omkring hvert kulstof er næsten 120.. Således viser vores billede brugen af sp2-hybrider (fordi de har 120° vinkler mellem hinanden) til opførelsen af sigma-bindingerne. 1-bindingen dannes ved overlapning af to p. – orbitaler. Det er vigtigt at bemærke, at 1-bindingen indfører en barriere for rotation omkring carbon-carbon-forbindelsen., Det vil sige, at hvis en CH2-gruppe skulle rotere, skulle 1-bindingen brydes, hvilket ville kræve betydelig energi. Konsekvensen af dette er, at 1-bindingen fikserer de to CH2-grupper i et plan, hvilket får det samlede molekyle til at være plan.

Figur 36. Bindingen i ethen.
den molekylære orbitalmodel tager en anden tilgang. Det udnytter alle orbitalerne på alle atomerne til at generere et sæt orbitaler, der strækker sig over alle atomerne på hele molekylet., Den molekylære orbitalmodel er vanskeligere at visualisere, men den er også mere kraftfuld. Den vanskelige proces med at bestemme, hvordan man kombinerer atomkugler for at generere molekylære orbitaler, udføres nu af computeren for selv store molekyler. Den praktiserende kemiker bruger den molekylære orbitalmodel til at forudsige spektre, overgangstilstande osv., men til hverdagens kemiske diskussioner regerer elektronprik-og valensbindingsmodellerne stadig dagen.
Skriv et svar