Tryk og KMT
Den makroskopiske fænomener af pres kan forklares i termer af den kinetiske molekylær teori af gasser. Antag det tilfælde, hvor et gasmolekyle (repræsenteret af en kugle) er i en kasse, længde L (Figur 1). Ved at bruge de antagelser, der er anført ovenfor, og i betragtning af at kuglen kun bevæger sig i direction-retningen, kan vi undersøge forekomsten af kuglen, der kolliderer elastisk med en af boksens vægge.,
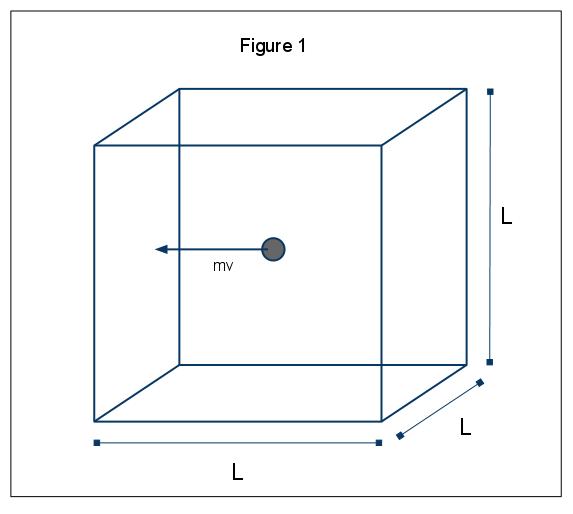
Det momentum af dette sammenstød er givet ved p=mv, i dette tilfælde s=mvx, da vi kun overvejer x dimension. Den samlede dynamik ændringer for denne kollision er da givet ved
\
i Betragtning af, at mængden af tid, det tager mellem kollisioner af molekylet med væggen er L/vx vi kan give hyppigheden af kollisioner af molekylet mod en given væg i max per tidsenhed som vx/2L., Man kan nu løse for ændringer i momentum per tidsenhed:
\
Løsning for momentum per tidsenhed giver den kraft, som udøves af et objekt (F=ma=p/tid)., Med det udtryk, som f=mv22/L man nu kan løse for det tryk, der udøves af den molekylære kollision, hvor området er angivet som området for den ene væg af kassen, A=L2:
\
\
udtrykket kan nu skrives med hensyn til det tryk, der er forbundet med kollisioner fra N antal molekyler:
\
dette udtryk kan nu justeres for at tage højde for bevægelse i directions -, y-og z-retningerne ved hjælp af middel-kvadrat hastighed for tre dimensioner og en stor værdi af N., Udtrykket er nu skrevet som:
\
dette udtryk giver nu tryk, en makroskopisk kvalitet, hvad angår atombevægelse. Betydningen af ovenstående forhold er, at trykket er proportional med den gennemsnitlige kvadratiske hastighed af molekyler i en given beholder. Derfor, som molekylær hastighed stiger så gør det tryk, der udøves på beholderen.
Skriv et svar