the Carbonyl Group
C=O is prone to additions and nucleophillic attack because or carbon’s positive charge and oxygen’s negative charge. La resonancia de la carga positiva parcial de carbono permite que la carga negativa en el nucleófilo ataque al grupo carbonilo y se convierta en parte de la estructura y una carga positiva (generalmente un protón de hidrógeno) ataca el oxígeno., Solo un recordatorio, el nucleófilo es un buen ácido por lo tanto «le gustan los protones» por lo que atacará el lado con una carga positiva.
antes de considerar en detalle la reactividad de los aldehídos y las cetonas, necesitamos mirar hacia atrás y recordar cómo se ve la imagen de enlace en un carbonilo. Los carbonos carbonílicos son SP2 hibridados, con los tres orbitales sp2 formando soverlaps con orbitales en el oxígeno y en los dos átomos de carbono o hidrógeno. Estos tres enlaces adoptan Geometría trigonal plana., El orbital 2P restante sin hibridar en el carbono carbonilo central es perpendicular a este plano, y forma un pbond ‘lado a lado’ con un orbital 2p en el oxígeno.
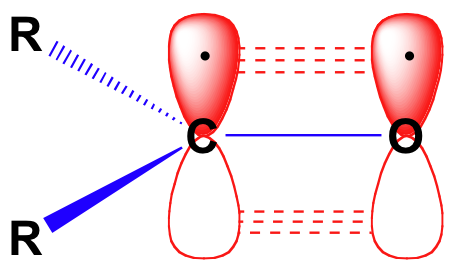
el doble enlace carbono-oxígeno es polar: el oxígeno es más electronegativo que el carbono, por lo que la densidad electrónica es mayor en el lado de oxígeno del enlace y menor en el lado de carbono. Recuerde que la polaridad de enlace se puede representar con una flecha dipolar, o mostrando el oxígeno como la celebración de una carga negativa parcial y el carbono carbonilo una carga positiva parcial.,

una tercera forma de ilustrar el dipolo carbono-oxígeno es considerar los dos principales contribuyentes de resonancia de un grupo carbonilo: la forma principal, que es lo que típicamente se ve dibujado en las estructuras de Lewis, y un contribuyente menor pero muy importante en el que ambos electrones en el pbond se localizan en el oxígeno, dándole una carga negativa completa. Esta última representación muestra el carbono con un orbital 2P vacío y una carga positiva completa.
Deja una respuesta