un subnivel es un nivel de energía definido por quantum theory.In química, subniveles se refieren a las energías asociadas con electrons.In física, los subniveles también pueden referirse a las energías asociadas con el núcleo.,
la primera teoría cuántica de Niels Bohr decía que los electrones ocupan capas esféricas centradas en el núcleo atómico, como las dos capas de electrones que se muestran para el litio a continuación:
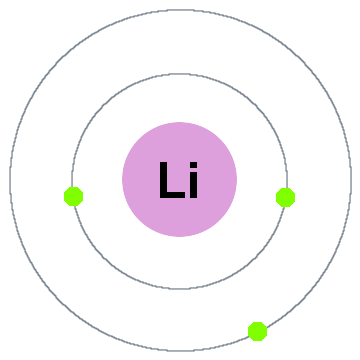
en este viejo modelo de capas moviéndose hacia afuera:
- Shell 1 puede contener hasta 2 electrones,
- Shell 2 puede contener hasta 8 electrones,
- Shell 3 puede contener hasta 18 electrones,
- Shell 4 Puede contener hasta 32 electrones,
- Shell 5 puede contener hasta 50 electrones,…
cada shell es en realidad un nivel de energía., Cuanto mayor sea la capa, mayor será la energía de su electrón(s). Todos los electrones que comparten una capa son degenerados, lo que significa que tienen la misma cantidad de energía.
Los avances en espectroscopia revelaron que las cáscaras pueden contener subcapas/subniveles.Los electrones en la capa 3, por ejemplo, pueden tener diferentes cantidades de energía unos de otros porque ocupan diferentes subniveles.
el diagrama de nivel de energía a continuación muestra subniveles tan altos como el nivel de energía de los orbitales 5f.,Los subniveles en realidad continúan a energías más altas que esto, pero 5f es un lugar adecuado para dejar una descripción introductoria.
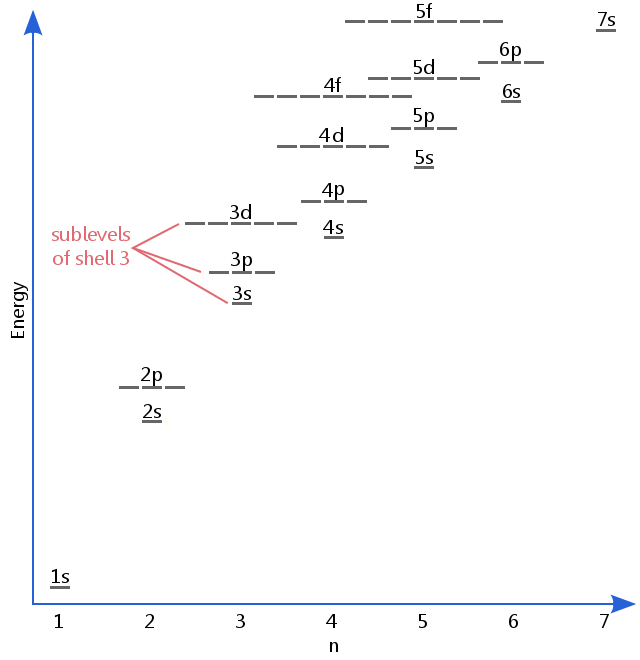

Electrónica de subniveles son conocidos por las letras s, p, d y f.Así, por ejemplo, los electrones en el subnivel s de shell 3 tienen una cantidad diferente de energía de los electrones en la p y la d de los niveles de shell 3.(Este no es el caso del hidrógeno., Todos los subniveles del hidrógeno tienen la misma energía, porque el hidrógeno solo tiene un electrón.)
s, p, d y f subniveles
El subnivel ocupado por ningún electrón está determinado por el electrón del número cuántico del momento angular, l.,div id=»7de4153d3c»>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
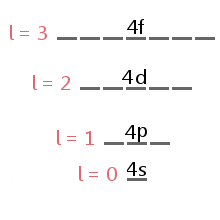
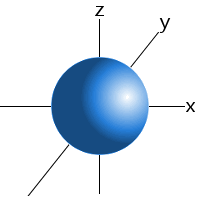
los orbitales subniveles tienen formas características que se pueden usar para explicar y predecir los enlaces químicos que los átomos pueden formar.Estas formas se basan en la probabilidad de encontrar un electrón en cualquier ubicación particular orbitando el núcleo.
por ejemplo, podemos decir que un electrón en el subnivel 1S de un átomo de hidrógeno se encontrará el 99 por ciento del tiempo en algún lugar de una esfera con un radio dado alrededor del núcleo.Esta es la razón por la que podemos dibujar los orbitales del subnivel s como una esfera.,
los orbitales para subniveles superiores también se dibujan sobre la base de dónde es más probable que se encuentren los electrones de un átomo. Ver orbitales para más detalles.
orbital de un subnivel s
ejemplos de subniveles
Ejemplos de los subniveles encontrados en varios átomos se muestran a continuación. El superíndice muestra el número de electrones en cada subnivel.
hidrógeno: 1S1
carbono: 1s2 2s2 2p2
cloro: 1s2 2s2 2p6 3s2 3P5
argón: 1s2 2s2 2p6 3s2 3p6
en general, los electrones van al subnivel de energía disponible más bajo., El orden general en el que se rellenan los subniveles es:
1s 2s 2p 3s 3p 4s 3d 4P 5s 4d 5p 6s 4f 5d 6P 7s 5f 6D 7P
dado esto, podemos responder preguntas como: «¿ Qué son los subniveles de electrones de potasio?»
El potasio tiene 19 electrones, y sabemos que los orbitales s tienen un máximo de dos electrones y p un máximo de seis. Los subniveles de electrones de potasio serán:
Deja una respuesta