Introducción
Las válvulas uretrales posteriores (PUV) son la causa congénita más común de obstrucción de la salida vesical pediátrica (1). Si bien la tasa de mortalidad por PUV ha mejorado significativamente con el tratamiento médico moderno, la uropatía obstructiva sigue siendo una fuente significativa de morbilidad en la edad adulta (2). Hasta el 80% de los niños con PUV presentan síntomas de incontinencia e infecciones del tracto urinario (3)., Además, hasta el 50% de los niños con PUV desarrollarán insuficiencia renal, siendo la uropatía obstructiva la causa congénita más común de trasplante renal (4). Las valvas de la válvula obstructiva se tratan quirúrgicamente poco después del nacimiento; sin embargo, los niños con PUV desarrollarán variabilidad en la función de la vejiga urinaria a lo largo de sus vidas. Se ha demostrado que el deterioro de la vejiga a menudo ocurre después de la pubertad, con una creciente necesidad de cateterismo intermitente limpio (5).
Los estudios que utilizan varios modelos animales han demostrado que la vejiga es sensible a las hormonas., Específicamente, se ha demostrado que el reemplazo de testosterona aumenta la masa muscular lisa y la proporción de músculo liso a colágeno en ratas orquiectomizadas (6). Se estudió un modelo de obstrucción parcial de la salida de la vejiga en ratones macho y se demostró que produce hipertrofia del músculo detrusor de la vejiga (7). Se ha demostrado que la testosterona aumenta la fibrosis detrusora en respuesta a la lesión por isquemia–reperfusión en conejos castrados (8). Sin embargo, hasta la fecha, el efecto de las manipulaciones hormonales en la respuesta de la vejiga del ratón macho a la lesión producida por la obstrucción aún no se ha estudiado., Por lo tanto, planteamos la hipótesis de que la testosterona participa en los cambios fibróticos inadaptados que ocurren después de la obstrucción de la salida de la vejiga.
materiales y métodos
modelo murino de obstrucción parcial de la salida de la vejiga
todos los procedimientos quirúrgicos fueron aprobados por el Comité de cuidado y uso de animales del Stanley Manne Children’s Research Institute. Los ratones machos CD1 de ocho a diez semanas (Charles River Labs, Chicago, IL, EE. UU.) se alojaron en jaulas separadas para evitar cambios en los niveles de testosterona causados por el alojamiento grupal. Los ratones fueron anestesiados con isoflurano al 3% y colocados en decúbito supino., Se afeitó la parte inferior del abdomen y se preparó con solución de providone-yodo. Después de asegurar una inducción satisfactoria de la anestesia, se realizó una incisión en la piel de la línea media del abdomen inferior y se llevó a cabo a través de la pared abdominal. La obstrucción de la salida vesical se llevó a cabo de manera similar a un informe anterior, pero con algunas diferencias (obstrucción parcial o grupo PO) (7). Tenga en cuenta que la obstrucción parcial se conoce típicamente como «pBOO», sin embargo, nos referiremos al grupo de cirugía y experimental como PO., Con tracción ascendente en la vejiga, se llevó a cabo una disección contundente alrededor del cuello de la vejiga (proximal a la próstata en ratones machos) mientras que ocasionalmente se retrae la vejiga caudalmente para asegurar que la disección sea anterior a los uréteres. Luego se pasó una sutura de polipropileno 7-0 alrededor del cuello de la vejiga y se ató sobre una aguja de calibre 23 colocada junto a la uretra. A continuación se retiró la aguja., Si los animales machos fueran castrados (obstrucción parcial castrada o CPO), simultáneamente se sacaron los testículos de la incisión abdominal, se ligaron los cordones espermáticos con 6-0 suturas de polipropileno y se dividieron bruscamente. La pared abdominal y la piel se cerraron por separado con 5-0 suturas de poliglactina de manera interrumpida. Los animales simulados se sometieron a un procedimiento idéntico hasta el punto de movilización de la vejiga. Se permitió que los animales se recuperaran, se les suministró carprofeno disuelto en agua de bebida y se sacrificaron a las 1 o 4 semanas después de los estudios funcionales descritos a continuación., Después del sacrificio por dislocación de la columna cervical bajo anestesia con isoflurano, se pesaron los animales y se diseccionaron las vejigas a nivel de la ligadura. Cada vejiga se vació de orina y luego se pesó por separado para 12 ratones simulados, 17 PO, 11 CPO y 11 CPOT.
administración de testosterona
el cipionato de testosterona se administró al grupo castrado, parcialmente obstruido en el momento de la castración y semanalmente en el postoperatorio a dosis de 10 mg/kg (grupo castrado de obstrucción parcial de testosterona o CPOT)., Para los ratones que recibieron reemplazo de testosterona, se extrajo sangre en el momento del sacrificio y se envió para el ensayo comercial de testosterona para garantizar que recibieran un reemplazo adecuado (Antech Diagnostics, Irvine, CA, EE.
tinción miccional sobre papel (VSOP)
la VSOP se realizó las mañanas de los días 1, 7 y 28 del postoperatorio para cada ratón. Los ratones se mantuvieron en jaulas metabólicas con papel de filtro Whatman subyacente durante 2 h y se les dio acceso sin restricciones a alimentos y agua. Se tomaron imágenes de las hojas de papel de filtro., Se observó el número y el patrón de los vacíos y se midió el área de cada tinción miccional utilizando ImageJ (National Institutes of Health, Bethesda, MD, USA). Usando una curva estándar creada a partir de manchas de micción de volúmenes conocidos de orina, el área de la mancha se convirtió en volumen de micción. Se analizó el volumen máximo vaciado.
análisis histológico
las vejigas se fijaron en formalina (Sigma) al 10% (P / V) durante 24 h, incrustadas en parafina y cortadas transversalmente con el cuello de la vejiga orientado hacia abajo para producir secciones de 4 µm. Las secciones de 4 ratones simulados, 4 PO, 4 CPO y 4 CPOT fueron teñidas con tricrómico de Masson., Se tomaron imágenes de las secciones con aumentos de 10× y 40× utilizando un microscopio vertical Leica conectado a una cámara y las imágenes se almacenaron digitalmente utilizando OpenLab Para Mac. La relación Col/SM se cuantificó utilizando Adobe Photoshop como se describió anteriormente y se promedió a partir de cuatro secciones de 40× por vejiga. Para la inmunotinción, las vejigas se fijaron en formaldehído al 4% (P/v) hecho de paraformaldehído (EM Sciences) durante la noche. El tejido se lavó en DPBS y se equilibró secuencialmente en 20% (P/v) y 30% (p/v) sacarosa (Sigma) en DPBS., Los tejidos se congelaron en moldes pelables que contenían OCT (Tissue Tech) en un baño de isopentano de hielo seco (Sigma).
se utilizaron anticuerpos de inmunofluorescencia
vejigas fijas de 3 ratones simulados, 3 PO, 3 CPO y 3 CPOT. Se cortaron secciones de 10 µm para todos los experimentos. Las secciones se lavaron dos veces en PBS, se incubaron durante 5 min a temperatura ambiente en PBS + 0.1% Tween (PBT) y se bloquearon durante 30 min a temperatura ambiente con 10% de suero de burro en PBT., La miosina de músculo liso (SMM) se detectó de la misma manera utilizando la miosina de músculo liso de conejo (tecnologías biomédicas, 1:100) junto con el anticuerpo secundario Alexa Fluor 546 donkey anti-rabbit (Life Technologies, 1:400).
análisis estadístico
los grupos se compararon mediante ANOVA con el análisis post hoc Student-Newman-Keuls. Los resultados con P < 0,05 fueron considerados significativos. Para el análisis estadístico se utilizó el programa SPSS v22.0. Las barras de Error en las figuras reflejan SEM.,
resultados
el PO conduce a cambios funcionales determinados por estudios urodinámicos y tinción miccional en papel
la obstrucción parcial de la salida vesical se realizó en ratones machos CD-1 y se comparó con dos grupos: ratones machos sometidos a cirugía simulada y ratones machos sometidos a obstrucción parcial de la salida vesical con castración. Medimos los niveles séricos de testosterona en ratones castrados y encontramos que los niveles cayeron a (<20 pg/dL) dentro de las 24 h después de la orquiectomía., Los efectos de la obstrucción en la función vesical se determinaron utilizando estudios urodinámicos en estos tres grupos. La figura 1a muestra presiones de micción pico elevadas 1 semana después de la obstrucción en los ratones PO y CPO en comparación con los ratones de cirugía simulada. Los trazados urodinámicos representativos también muestran inestabilidad a 1 semana en ratones PO y CPO (figura 1C). La VSOP realizada a la 1 semana después de la obstrucción refleja el efecto de la obstrucción en ratones PO y CPO que no se observa en ratones de cirugía simulada (Figuras 1B,D)., Así, nuestro modelo de PO tuvo efectos funcionales significativos sobre la micción en ratones PO y CPO 1 semana después de la cirugía.
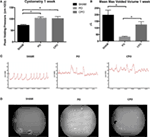
la Figura 1. Cistometría (a) y volúmenes máximos medios vaciados (B) de ratones 1 semana después de someterse a PO. Las columnas son (de izquierda a derecha) Sham, PO, CPO. C) trazados representativos del análisis de cistometría. D) imágenes representativas de manchas de micción en papel Whatman colocado debajo de ratones durante 2 h como se visualiza con imágenes ultravioleta. Las barras de Error son SEM., La significación estadística (P < 0,05) se indica encima de las barras con un asterisco.
aunque la obstrucción en ratones CPO se demostró a 1 semana, los efectos de la obstrucción se resolvieron a las 4 semanas. La VSOP realizada a las 4 semanas después de la obstrucción demuestra que los ratones PO tienen patrones de micción obstructiva persistente con volúmenes vaciados máximos más pequeños que los ratones CPO. Al mismo tiempo, los ratones CPO recuperan volúmenes máximos vaciados similares a los ratones de cirugía simulada (figuras 3A–C)., El patrón general en VSOP de ratones CPO ha vuelto a la normalidad, mientras que los ratones PO continúan demostrando una pulverización indiscreta de orina que indica pérdida del control de la vejiga.
El remodelado de la vejiga después de la PO es alterado por la castración
encontramos que los efectos sobre la función de la vejiga se correlacionaron con cambios macroscópicos en la vejiga del ratón en ratones PO y CPO. En el momento del sacrificio del ratón a las 4 semanas después de la PO, las vejigas simuladas parecían normales en tamaño, pero la vejiga de PO y CPO estaban muy agrandadas (Figuras 2A,C–E)., Después de la disección de la vejiga distal a la ligadura del cuello de la vejiga, se expresaron vejigas de orina y se pesaron. Aquí, encontramos un aumento del peso de la vejiga en los ratones PO en comparación con los ratones de cirugía simulada y CPO. Los ratones CPO no mostraron aumento de peso en comparación con los ratones de cirugía simulada (figura 2b). La evaluación histológica de las vejigas de estos ratones se realizó con H&e se comparó el área, la circunferencia y el grosor de la vejiga., Tanto los ratones CPO como PO mostraron un aumento de área y circunferencia en comparación con los ratones de cirugía simulada, lo que refleja cambios de presiones vesicales elevadas después de PO (Figuras 2F,H). Sin embargo, solo se observó un aumento del grosor de la vejiga en ratones PO (figura 2G). Esto se correlacionó con el menor peso de la vejiga en ratones CPO, lo que sugiere que el aumento en el tamaño de la vejiga se debe principalmente al «estiramiento» del músculo de la vejiga en comparación con la hipertrofia o hiperplasia del músculo de la vejiga real.
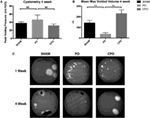
la Figura 3., Cistometría (A) y volúmenes máximos medios vaciados (B) 4 semanas después de la farsa o PO. (C) imágenes representativas de manchas miccionales de ratones simulados, PO o CPO 1 y 4 semanas después de la cirugía. Las barras de Error son SEM. La significación estadística se indica arriba de las barras con asteriscos (**p < 0.01). NS indica que la diferencia no fue estadísticamente significativa.,
la Fibrosis vesical aumenta después de la obstrucción parcial de la salida vesical
con el fin de investigar si el aumento de la masa vesical y del grosor de la pared vesical se debió únicamente a hipertrofia/hiperplasia muscular o si estaba involucrado un componente de fibrosis, se realizó un examen histológico de las vejigas de ratón simuladas, PO y CPO a las 4 semanas después de la obstrucción. Esto se hizo utilizando tanto la tinción de tricrómico de Masson como la inmunofluorescencia específica para marcadores de fibrosis (Figura 4)., Como era de esperar, en ratones PO, después de la obstrucción, se encontró que las vejigas habían aumentado las relaciones Col / SM. Con la castración, el aumento de la relación Col/SM ya no se encontró (figura 4B). A pesar de que el volumen de la vejiga luminal se incrementó en ratones CPO, la capa muscular no mostró hipertrofia como se evidencia por tener el mismo grosor de la pared vesical que los ratones de cirugía simulada. Además, la evaluación de los marcadores específicos de fibrosis vimentina, Col1a1 y FSP-1 por inmunofluorescencia demostró una mayor expresión en ratones PO en comparación con ratones simulados, con una disminución correspondiente en la expresión en ratones CPO., Parece que la castración crea condiciones en las que se produce la remodelación de la vejiga no fibrótica, argumentando un papel potencial de la testosterona específicamente en la mediación de una respuesta fibrótica a la lesión de la vejiga.
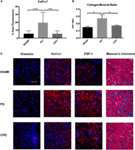
la Figura 4. Presencia de proteínas fibróticas en la pared de la vejiga después de PO. (A) gráfico de barras que muestra el porcentaje medio de fluorescencia del área para Col1a1. El significado es indicado por ***P < 0,001 o ****P < 0.0001. (B) gráfico de barras que muestra la relación Col/SM en vejigas simuladas, PO y CPO., La significación está indicada por * p < 0.05. C) imágenes representativas de inmunofluorescencia para vimentina, Col1a1, FSP-1 y tricrómico de Masson. La tinción de anticuerpos es roja y la contra-tinción DAPI es azul. Las filas de paneles son secciones de (de arriba a abajo) Sham, PO y CPO. Las filas se indican a la izquierda. La barra de aumento en el panel superior izquierdo es de 100 µm y representa el aumento para todos los paneles.,
la introducción de testosterona exógena revierte los efectos beneficiosos de la castración después de la obstrucción parcial de la salida vesical
hemos demostrado que la castración en el entorno de PO atenuará el remodelado post-obstructivo en relación con la hipertrofia / hiperplasia vesical y la fibrosis. Para demostrar que esta es una respuesta específica de testosterona, después de la castración, una cohorte de ratones se sometieron a PO y suplementos de testosterona. Aquí, utilizamos la testosterona o su dihidrotestosterona producto reducido (DHT)., DHT tiene 10 veces la afinidad para el receptor del andrógeno comparado a la testosterona y no se puede aromatizar al estrógeno, reduciendo la probabilidad que los cambios que ocurren de la suplementación de la testosterona son debido a niveles crecientes del estrógeno. Los volúmenes máximos vaciados determinados por VSOP fueron significativamente más bajos en ratones CPO más testosterona (CPOT) o CPO más DHT (CPOD) en comparación con los ratones CPO (figura 5A). Los cambios macroscópicos y microscópicos observados en ratones PO (pero no ratones CPO) reaparecieron en vejigas CPOT y CPOD., El peso de la vejiga aumentó significativamente en los ratones CPOT y CPOD en comparación con los ratones CPO (figura 5B). Las vejigas CPOT y CPOD también presentaron un aumento de las relaciones Col/SM en comparación con la CPO (figura 5D). Los marcadores de Fibrosis también aumentaron en CPOT y CPOD en comparación con las vejigas de CPO,al igual que la reacción a la tinción de tricrómico de Masson (Figuras 5C, E). Estos hallazgos demuestran que el reemplazo exógeno de testosterona en ratones macho castrados restauró completamente los efectos patológicos de la obstrucción a la vejiga urinaria., En suma, los efectos de la castración y el reemplazo de testosterona apoyan fuertemente un papel para el andrógeno masculino en la patogénesis de la obstrucción de la vejiga.
discusión
Los niños nacidos con PUV se someten a resección quirúrgica de las valvas obstructivas poco después del parto. Sin embargo, a pesar de aliviar la obstrucción de la salida de la vejiga en estos niños, muchos pacientes con PUV progresan hacia el deterioro de la vejiga que requiere un cateterismo intermitente limpio para vaciar adecuadamente la vejiga (3). Estos cambios se observaron a menudo después de la pubertad., Los cambios clínicos en pacientes con válvulas resecadas se atribuyeron previamente a cambios fisiológicos asociados con la adolescencia, como el aumento de la filtración urinaria, y no a cambios hormonales (1, 5, 9). Sin embargo, nuestros hallazgos sugieren que los andrógenos pueden desempeñar un papel más importante de lo que se apreció anteriormente. Encontramos que la presencia o ausencia de andrógenos afecta específicamente los cambios celulares que se producen después de la obstrucción, en particular la fibrosis.,
la información de estudios en los que se suplementó testosterona en pacientes con enfermedad del tracto urinario inferior podría dar una idea de los efectos de los andrógenos en la enfermedad de la vejiga. Estos datos son relativamente escasos, procedentes en gran medida de estudios observacionales retrospectivos o prospectivos y estudios en los que se administró testosterona a hombres hipogonadales o eugonadales. Sin embargo, estos estudios sugieren que la suplementación con testosterona no empeora las LUTS (10, 11)., Específicamente, múltiples estudios han demostrado una mejora en la puntuación IPSS en hombres que reciben suplementos de andrógenos, aunque muchos de ellos no estudiaron específicamente a hombres con obstrucción conocida de la salida de la vejiga, sino que más bien incluyen una cohorte tratada con suplementos de testosterona y que tienen diversos grados de LUTS al inicio del estudio. Un estudio excluyó a los pacientes con obstrucción conocida del cuello vesical. Koritsiadis et al., comparó específicamente síntomas y parámetros urodinámicos en estudios de presión-flujo de hombres hipogonadales y eugonadales y encontró que el nivel sérico de testosterona estaba correlacionado negativamente con la presión detrusora en el flujo máximo, pero no IPSS ni ningún otro parámetro urodinámico (12).
el efecto de la testosterona en el músculo detrusor de la vejiga también se ha estudiado en modelos animales. Tek y sus colegas encontraron que la suplementación con testosterona de ratas castradas quirúrgicamente resultó en una disminución de la relación colágeno / músculo liso y un aumento de la capacidad cistométrica (13). Shortliffe et al., (14) encontraron que el reemplazo de testosterona en ratas castradas quirúrgicamente también se asoció con el aumento del músculo liso de la vejiga, así como el aumento de la masa vesical (14). En conjunto, estos estudios indican que en ratas sin obstrucciones, la testosterona estimula el crecimiento del músculo liso detrusor a través de un mecanismo aún poco claro. En un modelo de lesión vesical por isquemia-reperfusión en conejos machos, Chuang et al. demostró que la castración era protectora al disminuir la fibrosis vesical y disminuir la expresión de varios marcadores relacionados con la fibrosis (8)., La suplementación con testosterona de estos conejos castrados condujo a un aumento de la fibrosis detrusora después de una lesión en la vejiga. Nuestros hallazgos reflejan estos hallazgos y representan el primer estudio del efecto de la testosterona en la respuesta a la lesión vesical por PO en ratones juveniles.
al mismo tiempo, la escasez de hallazgos en la literatura nos sorprendió por nuestros hallazgos iniciales. Una preocupación potencial que teníamos era que los ratones no estaban suficientemente obstruidos y que nuestros hallazgos en ratones castrados representaban un grupo en el que la obstrucción simplemente no ocurrió., Al final, sabemos que esto no es cierto porque las vejigas en el grupo CPO inicialmente tenían manchas miccionales como el grupo obstruido, tenían presiones anormales por cistometría y tenían vejigas remodeladas. De hecho, las vejigas de los ratones CPO fueron muy diferentes a las simulaciones, lo que indica que la cirugía PO produjo efectos profundos. Nuestra interpretación de estos hallazgos es que en las horas posteriores a la cirugía, la presión aumenta dentro de la pared de la vejiga y que, en ratones normales, se construyen colágenos y otras matrices de rigidez para evitar la ruptura de la vejiga en el abdomen., Las vejigas de los ratones CPO tenían muy poca deposición de colágeno dentro del músculo detrusor, pero al mismo tiempo, se hicieron muy grandes con paredes delgadas. Es posible que cuando la respuesta fibrótica se ve afectada en una vejiga de alta presión, se estire para acomodar la orina que se acumula. Esto es típico de lo que observamos en CPO, pero no en las vejigas de PO y CPOT. Por lo tanto, planteamos la hipótesis de que el papel de la testosterona puede ser específicamente en la mediación de la fibrosis en la pared de la vejiga.,
si bien nuestro trabajo utilizó específicamente un modelo de vejiga para determinar el papel de la testosterona en la fibrosis muscular en respuesta a la lesión del músculo liso, creemos que esta investigación demostrará ser importante en muchos procesos de enfermedades fibróticas que tienen una asociación sexual. De hecho, esto ha sido apoyado por algunos estudios en la literatura. Cho et al. demostró que la orquiectomía atenuó la fibrosis renal observada después de la obstrucción ureteral. En un modelo de ratón de obstrucción ureteral unilateral, los riñones de ratones macho demostraron una mayor expresión de Alfa-SMA y deposición de colágeno (15)., Al igual que nuestro modelo de obstrucción vesical, esta respuesta fibrótica se minimizó si se realizaba orquiectomía concomitante con obstrucción ureteral. Se notificaron hallazgos análogos en un modelo de ratón de fibrosis cardíaca secundaria a sobrecarga de presión. Aquí, los cambios fibróticos en el ventrículo izquierdo fueron atenuados por orquiectomía. Esto incluyó un embotamiento de la vía de señalización de TGFß, conocida por ser importante para promover la diferenciación de miofibroblastos (16). La fibrosis cardíaca y renal relacionada con la edad también se atenuó mediante orquiectomía en ratones machos (17)., Además, en un estudio de Zhu y colegas, el receptor de andrógenos en las células musculares lisas vasculares estaba implicado en la calcificación del músculo liso estimulada por testosterona. Usando células vasculares del músculo liso derivadas de un ratón knockout del receptor del andrógeno del músculo liso-específico, la calcificación fue embotada en respuesta al tratamiento de la testosterona comparado al tipo salvaje células del músculo liso (18). Así, un número creciente de estudios, incluyendo el Nuestro, están encontrando una asociación entre la testosterona y los cambios patológicos asociados a la fibrosis.,
el mecanismo detrás del papel de la testosterona en la modulación de la respuesta del detrusor a la lesión sigue siendo inexplicable. El trabajo adicional que investiga los efectos aguas abajo de la testosterona en el músculo del detrusor podría revelar las dianas terapéuticas nuevas que se podrían utilizar para prevenir o por lo menos para mejorar la remodelación adversa del tejido vista en el ajuste del PO. Además, se podrían realizar estudios de dosis-respuesta para determinar a qué concentraciones séricas de testosterona conducen a una remodelación adversa. Se ha demostrado que el estrógeno atenúa la hipoxia tisular y la lesión del detrusor asociada en modelos animales., Estudio adicional de la interacción entre la testosterona y el estrógeno en la modulación de la respuesta del músculo detrusor a la lesión también puede ayudar a dilucidar aún más esta vía.
conclusión
Los ratones machos juveniles con obstrucción parcial de la salida de la vejiga tienen vejigas de alta presión más pequeñas que son fibróticas. La castración se relacionó con mayores volúmenes anulados, menor peso vesical y menos fibrosis detrusora. El reemplazo de testosterona en ratones castrados revirtió estos efectos., Esto indica que la testosterona juega un papel en la modificación de las alteraciones del músculo detrusor después de la obstrucción parcial de la salida de la vejiga en ratones. Por lo tanto, sugerimos que el aumento de los niveles de testosterona en niños con PUV puede contribuir a la disminución de la función de la vejiga.
Declaración ética
Este estudio se realizó de acuerdo con las recomendaciones de las guías quirúrgicas, el Comité de uso y Cuidado de animales. El protocolo fue aprobado por el Comité de uso y Cuidado de animales.
contribuciones de los autores
recopilación y análisis de datos AF, PF, DB, NK y GS., AF, PF, RD y EG concepción, diseño y escritura de manuscritos.
Declaración de conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
financiación
Esta investigación fue apoyada por la financiación de la Asociación Hartwell a EG.
4. Holmdahl G, Sillen U. niños con válvulas uretrales posteriores: resultado relativo a la función renal, la función vesical y la paternidad a las edades de 31 a 44 años., J Urol (2005) 174(3):1031–4; discussion 1034. doi:10.1097/01.ju.0000170233.87210.4f
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Holmdahl G, Sillen U, Hanson E, Hermansson G, Hjalmas K. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol (1996) 155(2):694–8. doi:10.1097/00005392-199602000-00094
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Gallo CBM, Miranda AF, Felix-Patricio B, Ramos CF, Cardoso LEM, Costa WS, et al. Effects of castration and hormone replacement in the urinary bladder of rats: structural, ultrastructural, and biochemical analysis. J Androl (2012) 33(4):684–90. doi:10.2164/jandrol.111.014159
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Austin JC, Chacko SK, DiSanto M, Canning DA, Zderic SA., Un modelo murino masculino de obstrucción parcial de la salida vesical revela cambios en la morfología del detrusor, contractilidad y expresión de la isoforma de miosina. J Urol(2004) 172 (4 Pt 1): 1524-8. doi: 10.1097 / 01.ju.0000138045.61378.96
PubMed Abstract | CrossRef Texto Completo | Google Scholar
11. Yassin D-J, El Douaihy y, Yassin AA, Kashanian J, Shabsigh R, Hammerer PG., Los síntomas del tracto urinario inferior mejoran con la terapia de reemplazo de testosterona en hombres con hipogonadismo de inicio tardío: estudio de registro prospectivo, observacional y longitudinal a 5 años. World J Urol (2014) 32(4):1049-54. doi: 10.1007 / s00345-013-1187-z
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cho MH, Jung KJ, Jang HS, Kim JI, Park km. La orquiectomía atenúa la fibrosis renal después de la obstrucción ureteral mediante la reducción del estrés oxidativo en ratones. Am J Nephrol (2012) 35(1):7-16. doi: 10.,1159/000334598
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Montalvo C, Villar AV, Merino D, Garcia R, Ares M, Llano M, et al. Androgens contribute to sex differences in myocardial remodeling under pressure overload by a mechanism involving TGF-beta. PLoS One (2012) 7(4):e35635. doi:10.1371/journal.pone.0035635
CrossRef Full Text | Google Scholar
17., Hewitson TD, Zhao C, Wigg B, Lee SW, Simpson ER, Boon WC, et al. La relaxina y la castración en ratones machos protegen de la fibrosis cardíaca y renal relacionada con la edad, pero la testosterona la exacerba, mientras que los estrógenos son un determinante independiente del tamaño del órgano. Endocrinología (2012) 153(1):188-99. doi:10.1210/es.2011-1311
PubMed Abstract | CrossRef Texto Completo | Google Scholar
18. Zhu D, Hadoke PW, Wu J, Vesey AT, Lerman DA, Dweck MR, et al., Ablation of the androgen receptor from vascular smooth muscle cells demonstrates a role for testosterone in vascular calcification. Sci Rep (2016) 6:24807. doi:10.1038/srep24807
PubMed Abstract | CrossRef Full Text | Google Scholar
Deja una respuesta