antecedentes
La insulina es una hormona que regula la cantidad de glucosa (azúcar) en la sangre y es necesaria para que el cuerpo funcione normalmente. La insulina es producida por células en el páncreas, llamadas los islotes de Langerhans. Estas células liberan continuamente una pequeña cantidad de insulina en el cuerpo, pero liberan oleadas de la hormona en respuesta a un aumento en el nivel de glucosa en sangre.,
ciertas células del cuerpo transforman los alimentos ingeridos en energía, o glucosa en sangre, que las células pueden utilizar. Cada vez que una persona come, la glucosa en sangre aumenta. El aumento de la glucosa en sangre hace que las células de los islotes de Langerhans liberen la cantidad necesaria de insulina. La insulina permite que la glucosa en sangre sea transportada de la sangre a las células. Las células tienen una pared externa, llamada membrana, que controla lo que entra y sale de la célula. Los investigadores aún no saben exactamente cómo funciona la insulina, pero sí saben que la insulina se une a los receptores de la membrana celular., Esto activa un conjunto de moléculas de transporte para que la glucosa y las proteínas puedan entrar en la célula. Las células pueden entonces utilizar la glucosa como energía para llevar a cabo sus funciones. Una vez transportado a la célula, el nivel de glucosa en sangre vuelve a la normalidad en cuestión de horas.
sin insulina, la glucosa en sangre se acumula en la sangre y las células carecen de su fuente de energía. Algunos de los síntomas que pueden ocurrir incluyen fatiga, infecciones constantes, visión borrosa de los ojos, entumecimiento, hormigueo en las manos o las piernas, aumento de la sed y lentitud en la curación de moretones o cortes., Las células comenzarán a utilizar la grasa, la fuente de energía almacenada para emergencias. Cuando esto sucede durante demasiado tiempo, el cuerpo produce cetonas, sustancias químicas producidas por el hígado. Las cetonas pueden envenenar y matar células si se acumulan en el cuerpo durante un período prolongado de tiempo. Esto puede conducir a una enfermedad grave y coma.
Las personas que no producen la cantidad necesaria de insulina tienen diabetes. Hay dos tipos generales de diabetes. El tipo más grave, conocido como diabetes tipo I O de aparición juvenil, es cuando el cuerpo no produce insulina., Los diabéticos tipo I generalmente se inyectan diferentes tipos de insulina tres o cuatro veces al día. La dosis se toma en base a la lectura de glucosa en sangre de la persona, tomada de un medidor de glucosa. Los diabéticos tipo II producen algo de insulina, pero no es suficiente o sus células no responden normalmente a la insulina. Esto generalmente ocurre en personas obesas o de mediana edad y mayores. Los diabéticos tipo II no necesitan necesariamente inyectarse insulina, pero pueden inyectarse insulina una o dos veces al día.,
Hay cuatro tipos principales de insulina que se fabrican según la rapidez con que la insulina comienza a funcionar, cuándo alcanza su punto máximo y cuánto tiempo dura en el cuerpo. Según la Asociación Americana de Diabetes, la insulina de acción rápida llega a la sangre en 15 minutos, alcanza su punto máximo en 30-90 minutos y puede durar cinco horas. La insulina de acción corta llega a la sangre en 30 minutos, alcanza su punto máximo de dos a cuatro horas más tarde y permanece en la sangre durante cuatro a ocho horas., La insulina de acción intermedia llega a la sangre de dos a seis horas después de la inyección, alcanza su punto máximo de cuatro a 14 horas más tarde y puede durar en la sangre de 14 a 20 horas. Y la insulina de acción prolongada tarda de seis a 14 horas en comenzar a funcionar, tiene un pequeño pico poco después y permanece en la sangre durante 20-24 horas. Cada diabético tiene diferentes respuestas y necesidades de insulina, por lo que no hay un tipo que funcione mejor para todos. Un poco de insulina se vende con dos de los tipos mezclados en un frasco.,
historia
si el cuerpo no produce insulina alguna o suficiente, las personas deben tomar una versión fabricada de la misma. El uso principal de la producción de insulina es para los diabéticos que no producen suficiente o cualquier insulina de forma natural.
antes de que los investigadores descubrieran cómo producir insulina, las personas que sufrían de diabetes tipo I no tenían ninguna posibilidad de tener una vida saludable. Luego, en 1921, los científicos canadienses Frederick G. Banting y Charles H. Best purificaron con éxito la insulina del páncreas de un perro. A lo largo de los años, los científicos hicieron mejoras continuas en la producción de insulina., En 1936, los investigadores encontraron una manera de producir insulina con una liberación más lenta en la sangre. Agregaron una proteína que se encuentra en el esperma de los peces, la protamina, que el cuerpo descompone lentamente. Una inyección duró 36 horas. Otro avance se produjo en 1950 cuando los investigadores produjeron un tipo de insulina que actuó un poco más rápido y no permanece en el torrente sanguíneo tanto tiempo. En la década de 1970, los investigadores comenzaron a tratar de producir una insulina que imitara más cómo funcionaba la insulina natural del cuerpo: liberando una pequeña cantidad de insulina durante todo el día con oleadas que ocurren a la hora de las comidas.,
Los investigadores continuaron mejorando la insulina, pero el método básico de producción se mantuvo igual durante décadas. La insulina se extraía del páncreas del ganado bovino y porcino y se purificaba. La estructura química de la insulina en estos animales es ligeramente diferente de la insulina humana, por lo que funciona tan bien en el cuerpo humano. (Aunque algunas personas tuvieron un sistema inmunitario negativo o reacciones alérgicas. Luego, a principios de la década de 1980, la biotecnología revolucionó la síntesis de insulina. Los investigadores ya habían decodificado la estructura química de la insulina a mediados de la década de 1950., Pronto determinaron la ubicación exacta del gen de la insulina en la parte superior del cromosoma 11. En 1977, un equipo de investigación había empalmado un gen de insulina de rata en una bacteria que luego producía insulina.

en 1891, Frederick Banting nació en Alliston, Ontario. Se graduó en 1916 de la Facultad de Medicina de la Universidad de Toronto. Después del servicio del cuerpo médico en la Primera Guerra Mundial, Banting se interesó en la diabetes y estudió la enfermedad en la Universidad de Western Ontario.,
en 1919, Moses Barron, un investigador de la Universidad de Minnesota, mostró que el bloqueo del conducto que conecta las dos partes principales del páncreas causó el marchitamiento de un segundo tipo de célula, el acinar. Banting creía que al atar el conducto pancreático para destruir las células acinares, podía preservar la hormona y extraerla de las células de los islotes. Banting propuso esto al jefe del Departamento de Fisiología de la Universidad de Toronto, John Macleod., Macleod rechazó la propuesta de Banting, pero proporcionó espacio de laboratorio, 10 perros, y un estudiante de Medicina, Charles Best
comenzando en mayo de 1921, Banting y Best ataron los conductos pancreáticos en perros para que las células acinares se atrofiaran, luego eliminaron las pancreasas para extraer líquido de las células de los islotes. Mientras tanto, eliminaron las pancreasas de otros perros para causar diabetes, luego inyectaron el líquido de las células de los islotes. En enero de 1922, Leonard Thompson, de 14 años, se convirtió en el primer ser humano en ser tratado con éxito para la diabetes usando insulina.
Best recibió su título de médico en 1925., Banting insistió en que Best también fuera acreditado, y casi rechazó su Premio Nobel porque Best no estaba incluido. Best se convirtió en jefe del departamento de fisiología de la Universidad de Toronto en 1929 y director del Departamento de Banting y Best de Investigación Médica de la universidad después de la muerte de Banting en 1941.
en la década de 1980, los investigadores utilizaron la ingeniería genética para fabricar una insulina humana. En 1982, la Corporación Eli Lilly produjo una insulina humana que se convirtió en el primer producto farmacéutico aprobado por ingeniería genética., Sin necesidad de depender de animales, los investigadores podrían producir insulina genéticamente modificada en suministros ilimitados. Tampoco contenía ninguno de los contaminantes animales. El uso de insulina humana también eliminó cualquier preocupación sobre la transferencia de cualquier enfermedad animal potencial a la insulina. Mientras que las empresas todavía venden una pequeña cantidad de insulina producida a partir de animales, en su mayoría porcinos, desde la década de 1980 en adelante, los usuarios de insulina se movieron cada vez más a una forma de insulina humana creada a través de la tecnología de ADN recombinante., Según Eli Lilly Corporation, en 2001 el 95% de los usuarios de insulina en la mayor parte del mundo toman alguna forma de insulina humana. Algunas compañías han dejado de producir insulina animal por completo. Las empresas se están centrando en sintetizar insulina humana y análogos de insulina, una modificación de la molécula de insulina de alguna manera.
materias primas
la insulina humana se cultiva en el laboratorio dentro de bacterias comunes. Escherichia coli es, con mucho, el tipo de bacteria más utilizado, pero también se usa levadura.
Los investigadores necesitan la proteína humana que produce insulina., Los fabricantes obtienen esto a través de una máquina de secuenciación de aminoácidos que sintetiza el ADN. Los fabricantes conocen el orden exacto de los aminoácidos de la insulina (las moléculas a base de nitrógeno que se alinean para formar las proteínas). Hay 20 aminoácidos comunes. Los fabricantes introducen los aminoácidos de la insulina, y la máquina de secuenciación conecta los aminoácidos entre sí. También son necesarios para sintetizar insulina tanques grandes para hacer crecer las bacterias, y los nutrientes son necesarios para que las bacterias crezcan., Varios instrumentos son necesarios para separar y purificar el ADN, como una centrifugadora, junto con varios instrumentos de cromatografía y cristalografía de rayos X.
el proceso de fabricación
la síntesis de insulina humana es un proceso bioquímico de varios pasos que depende de técnicas básicas de ADN recombinante y una comprensión del gen de la insulina. El ADN contiene las instrucciones de cómo funciona el cuerpo y un pequeño segmento del ADN, el gen de la insulina, codifica la proteína insulina. Los fabricantes manipulan el precursor biológico de la insulina para que crezca dentro de bacterias simples., Si bien los fabricantes tienen sus propias variaciones, hay dos métodos básicos para fabricar insulina humana.
trabajando con insulina humana
- 1 El gen de la insulina es una proteína compuesta por dos cadenas separadas de aminoácidos, una a por encima de una cadena B, que se mantienen unidas mediante enlaces. Los aminoácidos son las unidades básicas que construyen todas las proteínas. La cadena a de insulina consta de 21 aminoácidos y la cadena B tiene 30.
- 2 antes de convertirse en una proteína insulínica activa, la insulina se produce primero como preproinsulina., Esta es una sola cadena de proteína larga con las cadenas A y B aún no separadas, una sección EN EL MEDIO que une las cadenas y una secuencia de señal en un extremo que indica a la proteína cuándo comenzar a segregar fuera de la célula. Después de la preproinsulina, la cadena evoluciona en proinsulina, siendo una sola cadena pero sin la secuencia de señalización. Luego viene la proteína activa insulina, la proteína sin la sección que une las cadenas A y B. En cada paso, la proteína necesita enzimas específicas (proteínas que llevan a cabo reacciones químicas) para producir la siguiente forma de insulina.,
comenzando por A y b
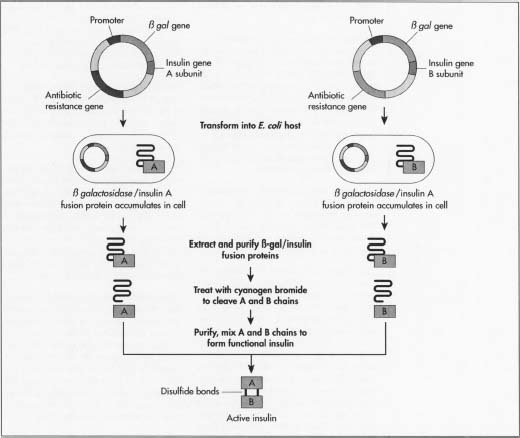
- 3 un método de fabricación de insulina es hacer crecer las dos cadenas de insulina por separado. Esto evitará la fabricación de cada una de las enzimas específicas necesarias. Los fabricantes necesitan los dos mini-genes: uno que produce la cadena A y otro para la cadena B. Dado que se conoce la secuencia exacta de ADN de cada cadena, sintetizan el ADN de cada mini-gen en una máquina de secuenciación de aminoácidos.
- 4 Estas dos moléculas de ADN se insertan en plásmidos, pequeñas piezas circulares de ADN que son más fácilmente absorbidas por el ADN del huésped.,
- 5 los fabricantes primero insertan los plásmidos en un tipo no dañino de la bacteria E. coli. Lo insertan junto al gen lacZ. LacZ codifica para la 8-galactosidasa, un gen ampliamente utilizado en procedimientos de ADN recombinante porque es fácil de encontrar y cortar, lo que permite que la insulina se elimine fácilmente para que no se pierda en el ADN de la bacteria. Junto a este gen se encuentra el aminoácido metionina, que inicia la formación de proteínas.
- 6 los plásmidos recombinantes, recién formados, se mezclan con las células bacterianas. Los plásmidos ingresan a las bacterias en un proceso llamado transfección., Los fabricantes pueden agregar a las células ADN ligasa, una enzima que actúa como pegamento para ayudar al plásmido a adherirse al ADN de la bacteria.
- 7 Las bacterias que sintetizan la insulina se someten a un proceso de fermentación. Se cultivan a temperaturas óptimas en grandes tanques en plantas de fabricación. Los millones de bacterias se replican aproximadamente cada 20 minutos a través de la mitosis celular, y cada una expresa el gen de la insulina.
- 8 Después de multiplicarse, las células se sacan de los tanques y se abren para extraer el ADN., Una forma común de hacer esto es agregando primero una mezcla de lisozoma que digiere la capa externa de la pared celular, luego agregando una mezcla de detergente que separa la membrana de la pared celular grasa. El ADN de la bacteria se trata con bromuro de cianógeno, un reactivo que divide las cadenas de proteínas en los residuos de metionina. Esto separa las cadenas de insulina del resto del ADN.
- 9 las dos cadenas se mezclan y se unen por enlaces disulfuro a través de la reacción de reducción-reoxidación. Se agrega un agente oxidante (un material que causa la oxidación o la transferencia de un electrón)., El lote se coloca en una centrífuga, un dispositivo mecánico que gira rápidamente para separar los componentes de la célula por tamaño y densidad.
- 10 la mezcla de ADN se purifica para que solo queden las cadenas de insulina. Los fabricantes pueden purificar la mezcla a través de varias técnicas de cromatografía o separación que explotan las diferencias en la carga, el tamaño y la afinidad de la molécula con el agua. Los procedimientos utilizados incluyen una columna de intercambio iónico, cromatografía líquida de alto rendimiento de fase inversa y una columna de cromatografía de filtración de gel., Los fabricantes pueden probar lotes de insulina para asegurarse de que ninguna de las proteínas de E. coli de la bacteria se mezcle con la insulina. Usan una proteína marcador que les permite detectar ADN de E. coli. Luego pueden determinar que el proceso de purificación elimina la bacteria E. coli.
PROINSULIN PROCESS
- 11 a partir de 1986, los fabricantes comenzaron a utilizar otro método para sintetizar insulina humana. Comenzaron con el precursor directo del gen de la insulina, la proinsulina., Muchos de los pasos son los mismos que cuando se produce insulina con las cadenas A y B, excepto que en este método la máquina de aminoácidos sintetiza el gen de proinsulina.
- 12 la secuencia que codifica la proinsulina se inserta en la bacteria E. coli no patógena. Las bacterias pasan por el proceso de fermentación donde se reproducen y producen proinsulina. Luego, la secuencia de conexión entre las cadenas A y B se empalma con una enzima y la insulina resultante se purifica.,
- 13 al final del proceso de fabricación se añaden ingredientes a la insulina para prevenir las bacterias y ayudar a mantener un equilibrio neutro entre ácidos y bases. También se añaden ingredientes a la insulina de acción intermedia y prolongada para producir el tipo de insulina de duración deseada. Este es el método tradicional para producir insulina de acción más prolongada. Los fabricantes agregan ingredientes a la insulina purificada que prolongan sus acciones, como el óxido de zinc. Estos aditivos retrasan la absorción en el cuerpo. Los aditivos varían entre las diferentes marcas del mismo tipo de insulina.,
insulina analógica
a mediados de la década de 1990, los investigadores comenzaron a mejorar la forma en que la insulina humana funciona en el cuerpo cambiando su secuencia de aminoácidos y creando un análogo, una sustancia química que imita a otra sustancia lo suficientemente bien como para engañar a la célula. La insulina analógica se acumula menos y se dispersa más fácilmente en la sangre, lo que permite que la insulina comience a funcionar en el cuerpo minutos después de una inyección. Hay varias insulinas analógicas diferentes. La insulina humulina no tiene enlaces fuertes con otras insulinas y, por lo tanto, se absorbe rápidamente., Otro análogo de la insulina, llamado glargina, cambia la estructura química de la proteína para que tenga una liberación relativamente constante durante 24 horas sin picos pronunciados.
en lugar de sintetizar la secuencia exacta de ADN para la insulina, los fabricantes sintetizan un gen de insulina donde la secuencia está ligeramente alterada. El cambio causa el resultado
las proteínas se repelen entre sí, lo que causa menos aglutinación., Usando esta secuencia de ADN modificada, el proceso de fabricación es similar al proceso de ADN recombinante descrito.
control de calidad
después de sintetizar la insulina humana, la estructura y la pureza de los lotes de insulina se prueban a través de varios métodos diferentes. La cromatografía líquida de alto rendimiento se utiliza para determinar si hay impurezas en la insulina. También se realizan otras técnicas de separación, como cristalografía de rayos X, filtración de gel y secuenciación de aminoácidos. Los fabricantes también prueban el embalaje del vial para asegurarse de que esté sellado correctamente.,
la fabricación de insulina humana debe cumplir con los procedimientos de los Institutos Nacionales de la salud para operaciones a gran escala. La administración de alimentos y Medicamentos de los Estados Unidos debe aprobar toda la insulina fabricada.
El Futuro
El futuro de la insulina tiene muchas posibilidades. Desde que la insulina se sintetizó por primera vez, los diabéticos necesitaban inyectar regularmente la insulina líquida con una jeringa directamente en su torrente sanguíneo. Esto permite que la insulina entre en la sangre inmediatamente. Durante muchos años fue la única forma conocida de mover la proteína de insulina intacta al cuerpo., En la década de 1990, los investigadores comenzaron a hacer incursiones en la síntesis de varios dispositivos y formas de insulina que los diabéticos pueden usar en un sistema alternativo de administración de medicamentos.
Los fabricantes están produciendo actualmente varios dispositivos de administración de medicamentos relativamente nuevos. Las plumas de insulina parecen una pluma de escribir. Un cartucho contiene la insulina y la punta es la aguja. El usuario fija una dosis, inserta la aguja en la piel y presiona un botón para inyectar la insulina. Con las plumas no es necesario utilizar un vial de insulina. Sin embargo, las plumas requieren insertar puntas separadas antes de cada inyección., Otro inconveniente es que la pluma no permite a los usuarios mezclar tipos de insulina, y no toda la insulina está disponible.
para las personas que odian las agujas, una alternativa a la pluma es el inyector de chorro. Con un aspecto similar a los bolígrafos, los inyectores de chorro usan presión para impulsar un pequeño chorro de insulina a través de la piel. Estos dispositivos no son tan utilizados como el lápiz, y pueden causar moretones en el punto de entrada.
La bomba de insulina permite una liberación controlada en el cuerpo. Esta es una bomba computarizada, del tamaño de un beeper, que los diabéticos pueden usar en su cinturón o en su bolsillo., La bomba tiene un pequeño tubo flexible que se inserta justo debajo de la superficie de la piel del diabético. El diabético configura la bomba para administrar una dosis constante y medida de insulina durante todo el día, aumentando la cantidad justo antes de comer. Esto imita la liberación normal de insulina del cuerpo. Los fabricantes han producido bombas de insulina desde la década de 1980, pero los avances a finales de la década de 1990 y principios del siglo XXI las han hecho cada vez más fáciles de usar y más populares. Los investigadores están explorando la posibilidad de implantar bombas de insulina., Los diabéticos controlarían estos dispositivos a través de un control remoto externo.
Los investigadores están explorando otras opciones de administración de medicamentos. La ingestión de insulina a través de píldoras es una posibilidad. El desafío con la insulina comestible es que el ambiente ácido del estómago destruye la proteína antes de que pueda pasar a la sangre. Los investigadores están trabajando en recubrir la insulina con plástico del ancho de unos pocos pelos humanos. Las cubiertas protegerían las drogas del ácido del estómago.,
en 2001 se están realizando pruebas prometedoras en dispositivos de insulina inhalados y los fabricantes podrían comenzar a producir los productos en los próximos años. Dado que la insulina es una proteína relativamente grande, no penetra en los pulmones. Los investigadores de la insulina inhalada están trabajando para crear partículas de insulina que sean lo suficientemente pequeñas como para llegar al pulmón profundo. Las partículas pueden pasar al torrente sanguíneo. Los investigadores están probando varios dispositivos de inhalación muy similares a los de un inhalador para el asma.
otra forma de dispositivo de aerosol que se somete a pruebas administrará insulina en la mejilla interna., Conocida como insulina bucal (mejilla), los diabéticos rociarán la insulina en el interior de su mejilla. Luego se absorbe a través de la pared interna de la mejilla.
los parches de insulina son otro sistema de administración de medicamentos en desarrollo. Los parches liberarían insulina continuamente en el torrente sanguíneo. Los usuarios tirarían de una lengüeta en el parche para liberar más insulina antes de las comidas. El desafío es encontrar una manera de que la insulina pase a través de la piel. El ultrasonido es un método que los investigadores están investigando. Estas ondas sonoras de baja frecuencia podrían cambiar la permeabilidad de la piel y permitir el paso de la insulina.,
otras investigaciones tienen el potencial de descontinuar la necesidad de los fabricantes de sintetizar insulina. Los investigadores están trabajando en la creación de las células que producen insulina en el laboratorio. La idea es que los médicos algún día pueden reemplazar las células del páncreas que no funcionan con células productoras de insulina. Otra esperanza para los diabéticos es la terapia génica. Los científicos están trabajando en corregir la mutación del gen de la insulina para que los diabéticos puedan producir insulina por su cuenta.
M. Rae Nelson
Deja una respuesta