presión y KMT
los fenómenos macroscópicos de presión se pueden explicar en términos de la teoría molecular cinética de gases. Supongamos el caso en el que una molécula de gas (representada por una esfera) está en una caja, Longitud L (Figura 1). Mediante el uso de las suposiciones expuestas anteriormente, y considerando que la esfera solo se mueve en la dirección x, podemos examinar la instancia de la esfera colisionando elásticamente con una de las paredes de la caja.,
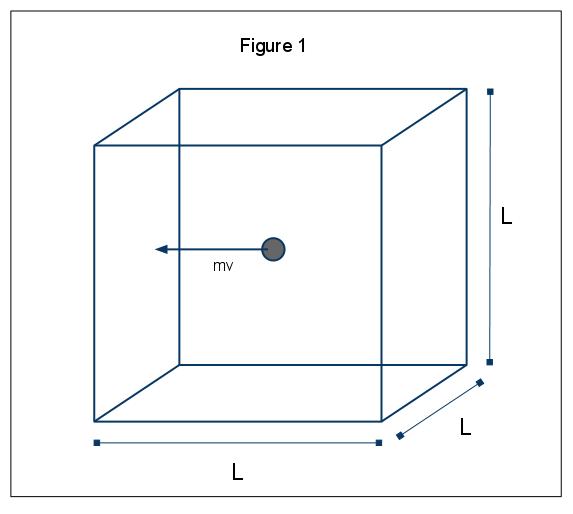
El impulso de esta colisión es dada por p=mv, en este caso p=mvx, dado que sólo estamos considerando la dimensión x. El cambio de momento total Para esta colisión es dado por
\
dado que la cantidad de tiempo que toma entre colisiones de la molécula con la pared es L/vx podemos dar la frecuencia de colisiones de la molécula contra una pared dada de la caja por unidad de tiempo como vx/2L., Ahora se puede resolver el cambio en el momento por unidad de tiempo:
\
resolver el momento por unidad de tiempo da la fuerza ejercida por un objeto (F=ma=p / time)., Con la expresión que F=mvx2/L ahora se puede resolver para la presión ejercida por la colisión molecular, donde el área se da como el área de una pared de la caja, a=L2:
\
\
\
la expresión ahora se puede escribir en términos de la presión asociada con las colisiones de n Número de moléculas:
\
Esta expresión ahora se puede ajustar para tener en cuenta el movimiento en las direcciones x, Y Y z utilizando para tres dimensiones y un gran valor de N., La expresión ahora se escribe como:
\
Esta expresión ahora da presión, una calidad macroscópica, en términos de movimiento atómico. La importancia de la relación anterior es que la presión es proporcional a la velocidad media cuadrada de las moléculas en un contenedor dado. Por lo tanto, a medida que aumenta la velocidad molecular también lo hace la presión ejercida sobre el contenedor.
Deja una respuesta