El Metoximetano tiene la misma fórmula molecular, el mismo número de electrones y aproximadamente la misma forma y tamaño que el etanol. A pesar de estas similitudes, las fórmulas estructurales (la organización de las moléculas individuales en el espacio) son diferentes entre el etanol (CH3CH2OH) y el metoximetano (CH3OCH3). Esta diferencia en la configuración de los átomos dentro de las moléculas tiene un efecto dramático en la volatilidad del etanol frente al metoximetano.,
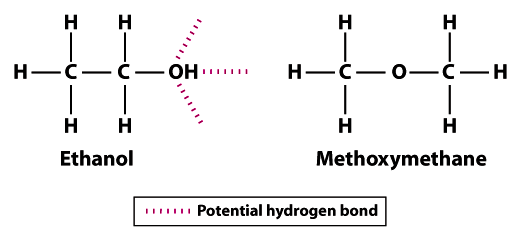 las estructuras muestran por qué el etanol es menos volátil que el metoximetano; el etanol puede formar tres enlaces de hidrógeno y el metoximetano no puede formar ninguno.Tenga en cuenta que los átomos de hidrógeno en el metoximetano no pueden participar en la Unión de hidrógeno con átomos de oxígeno vecinos. El átomo de hidrógeno del grupo hidroxilo (OH) en etanol aumenta el potencial de enlace de hidrógeno entre moléculas de etanol vecinas. En comparación con el metoximetano, el etanol no es tan volátil. El punto de ebullición de 78.5 ° C para el etanol es significativamente mayor en comparación con -24.,8°C para el metoximetano. Este ejemplo ilustra la importancia de la fuerza de enlace en general y el enlace de hidrógeno específicamente como un determinante de la volatilidad de una molécula.
las estructuras muestran por qué el etanol es menos volátil que el metoximetano; el etanol puede formar tres enlaces de hidrógeno y el metoximetano no puede formar ninguno.Tenga en cuenta que los átomos de hidrógeno en el metoximetano no pueden participar en la Unión de hidrógeno con átomos de oxígeno vecinos. El átomo de hidrógeno del grupo hidroxilo (OH) en etanol aumenta el potencial de enlace de hidrógeno entre moléculas de etanol vecinas. En comparación con el metoximetano, el etanol no es tan volátil. El punto de ebullición de 78.5 ° C para el etanol es significativamente mayor en comparación con -24.,8°C para el metoximetano. Este ejemplo ilustra la importancia de la fuerza de enlace en general y el enlace de hidrógeno específicamente como un determinante de la volatilidad de una molécula.
Deja una respuesta