no mucho después de que G. N. Lewis popularizara el modelo electrón-punto, la mecánica cuántica se convirtió en un modelo muy poderoso, incluyendo su uso para describir el enlace químico. Dos modelos developed el modelo de enlace de Valencia y el modelo orbital molecular were se desarrollaron casi simultáneamente. Linus Pauling se convirtió en el campeón del modelo valence bond, que es más fácil de visualizar y usar. Este modelo es esencialmente una versión mecánica cuántica del modelo electrón-punto: intenta describir qué orbitales son utilizados por cada átomo cuando los electrones son compartidos., Por ejemplo, cuando la molécula simple H2 se forma a partir de átomos de hidrógeno, el modelo de enlace de Valencia dice que un orbital s en un átomo se superpone con un orbital s en el otro para formar un enlace. Esto a veces se representa mediante un diagrama de superposición y una imagen como se muestra en la Figura 30.

Figura 30. Diagrama de superposición e imagen para la descripción del enlace de Valencia del hidrógeno diatómico.,
uno de los problemas que Pauling encontró al principio de sus esfuerzos pioneros con la teoría del enlace de Valencia está claramente ejemplificado por una simple imagen del enlace de Valencia en el agua. La Figura 31 muestra dos orbitales p en oxígeno superponiéndose con orbitales s en hidrógenos. Esta imagen muestra claramente que el ángulo de enlace en el agua debe ser de 90°, porque los dos orbitales p están alineados a lo largo de los ejes x e y y, por lo tanto, son perpendiculares.

Figura 31. Superposición Orbital en el agua.,
de hecho, el ángulo de enlace en el agua es de 105°, una desviación significativa de 90°. Este tipo de error puede no parecer significativo para usted, pero para alguien que intenta formular un modelo que explique tanto de una cierta parte de la naturaleza como sea posible, esta diferencia entre la teoría y el hecho experimental es muy molesta. Pauling luego añadió otra modificación a la teoría hybri hibridación., Pauling dijo que los orbitales atómicos en un átomo no son sacrosantos, son solo un posible conjunto de ecuaciones matemáticas (recuerde nuestra discusión del modelo de onda) que se pueden usar para describir los electrones en ese átomo. Se pueden generar otros conjuntos sumando y restando estos orbitales atómicos de acuerdo con ciertas reglas. Por lo tanto, si un orbital s y los tres orbitales p se combinan matemáticamente, se genera un nuevo conjunto de orbitales, SP3 orbitales. El nuevo conjunto de orbitales tiene diferentes características orientacionales que el conjunto de orbitales atómicos., La figura 32 muestra los orbitales s y tres P en la Parte (a) y luego en la Parte (b) los cuatro nuevos híbridos sp3. Como puedes ver, estos híbridos sp3 están orientados hacia las esquinas de un tetraedro. La Figura 33 muestra estos híbridos siendo utilizados para describir el enlace en el agua. Debido a que el ángulo entre los híbridos es de 109°, ahora esperamos que el ángulo de enlace en el agua sea de 109°. Claramente, esto nos da un mejor acuerdo con el valor experimental de 105°. (Note que esto no está en perfecto acuerdo, pero es lo mejor que podemos hacer., También son posibles otras combinaciones de hibridación, que se resumen en la figura 34.

figura 32. hibridación sp3.
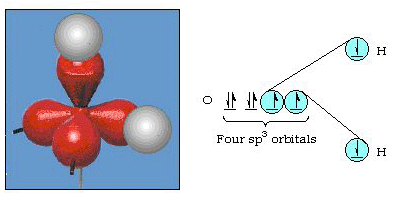
la Figura 33. Uso de híbridos sp3 para explicar el ángulo de enlace en el agua.
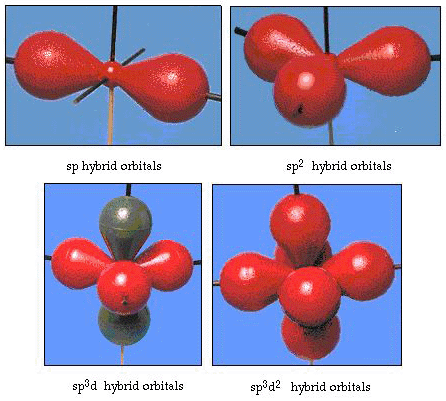
figura 34. Otros esquemas de hibridación.
press for video
hay otra característica del modelo de enlace de Valencia que merece discusión. Está muy bien ilustrado por nuestra molécula de oxígeno familiar, O2., La figura 35 muestra la superposición de dos orbitales px Para darnos un solo enlace. Si hemos de obedecer la regla del octeto, también debemos formar otro vínculo. Esto debe ser por superposición de dos orbitales py o PZ (no importa cuál). Este enlace tiene su densidad electrónica por encima y por debajo de la línea internuclear, en lugar de directamente entre los dos núcleos de oxígeno. Este Enlace se conoce como un enlace 1, mientras que el que pone la densidad electrónica entre los átomos se llama un enlace sigma (σ)., Una de las consecuencias interesantes de esta imagen es que se prevé que el enlace 1 sea más débil que el enlace sigma (la superposición de los orbitales es más débil). Esto significa que un enlace doble no tiene la fuerza de dos enlaces simples y también es más susceptible al ataque de átomos externos que buscan densidad electrónica.

figura 35. Formación de enlaces sigma y pi en oxígeno diatómico.,
como ejemplo final del tratamiento de enlace de Valencia de la Unión, La Figura 36 muestra una imagen de los orbitales involucrados en la Unión en eteno, el hidrocarburo insaturado más simple (H2C=CH2). Experimentalmente, se ha demostrado que los ángulos de enlace alrededor de cada carbono son casi 120°. Por lo tanto, nuestra imagen muestra el uso de híbridos sp2 (porque tienen ángulos de 120° entre sí) para la construcción de los enlaces sigma. El enlace 1 está formado por la superposición de dos orbitales pz. Es importante notar que el enlace 1 introduce una barrera a la rotación sobre el enlace carbono-carbono., Es decir, si un grupo CH2 rotara, el enlace 1 tendría que romperse, lo que requeriría una energía considerable. La consecuencia de esto es que el enlace 1 fija los dos grupos CH2 en un plano, causando que la molécula general sea plana.

figura 36. La Unión en eteno.
el modelo orbital molecular tiene un enfoque diferente. Utiliza todos los orbitales de todos los átomos para generar un conjunto de orbitales que se extienden sobre todos los átomos de toda la molécula., El modelo orbital molecular es más difícil de visualizar, pero también es más poderoso. El difícil proceso de determinar cómo combinar obitales atómicos para generar orbitales moleculares ahora se realiza por computadora incluso para moléculas grandes. El químico practicante utiliza el modelo orbital molecular para predecir espectros, estados de transición, etc., pero para las discusiones químicas cotidianas, los modelos electrón-punto y enlace de Valencia todavía gobiernan el día.
Deja una respuesta