Methoxymethane on sama molekyylikaava, sama määrä elektroneja, ja suunnilleen sama muoto ja koko kuin etanoli. Näistä yhtäläisyyksistä huolimatta rakenteelliset kaavat (yksittäisten molekyylien organisointi avaruudessa) eroavat etanolin (CH3CH2OH) ja metoksimetaanin (CH3OCH3) välillä. Tämä ero molekyylien atomien kokoonpanossa vaikuttaa dramaattisesti etanolin ja metoksimetaanin volatiliteettiin.,
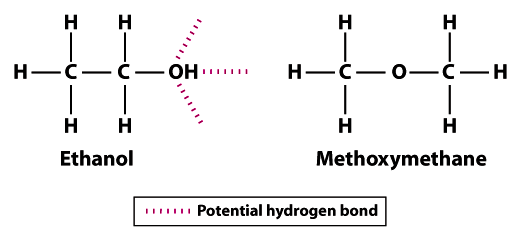 rakenteet osoittavat, miksi etanoli on vähemmän haihtuvia kuin methoxymethane; etanoli voi muodostaa kolme vetysidokset ja methoxymethane voi muodostaa mitään.Huomaa, että metoksimetaanin vetyatomit eivät voi osallistua vetysidokseen naapurimaiden happiatomien kanssa. Vety-atomin hydroksyyliryhmä (OH) etanoliin lisää mahdollisuuksia vety liimaus välillä naapurimaiden etanoli molekyylejä. Metoksimetaaniin verrattuna etanoli ei ole läheskään yhtä Haihtuva. Etanolin kiehumispiste 78,5°C on huomattavasti korkeampi kuin -24.,8°c metoksimetaanin osalta. Tämä esimerkki havainnollistaa merkitys sidoslujuus yleensä ja vety liimaus nimenomaan tekijä volatiliteetti molekyyli.
rakenteet osoittavat, miksi etanoli on vähemmän haihtuvia kuin methoxymethane; etanoli voi muodostaa kolme vetysidokset ja methoxymethane voi muodostaa mitään.Huomaa, että metoksimetaanin vetyatomit eivät voi osallistua vetysidokseen naapurimaiden happiatomien kanssa. Vety-atomin hydroksyyliryhmä (OH) etanoliin lisää mahdollisuuksia vety liimaus välillä naapurimaiden etanoli molekyylejä. Metoksimetaaniin verrattuna etanoli ei ole läheskään yhtä Haihtuva. Etanolin kiehumispiste 78,5°C on huomattavasti korkeampi kuin -24.,8°c metoksimetaanin osalta. Tämä esimerkki havainnollistaa merkitys sidoslujuus yleensä ja vety liimaus nimenomaan tekijä volatiliteetti molekyyli.
Vastaa