Ei kauan sen jälkeen, kun G. N. Lewis suosituksi electron-dot malli, kvanttimekaniikka tuli erittäin voimakas malli, mukaan lukien sen käyttö kuvaamaan kemiallisen sidoksen. Kaksi mallia-valence bond-malli ja molekyyliorbitaalimalli-kehitettiin lähes samanaikaisesti. Linus Paulingista tuli valence bond-mallin mestari, jota on helpompi visualisoida ja käyttää. Tämä malli on pohjimmiltaan elektronipistemallin kvanttimekaaninen versio: siinä yritetään kuvata, mitä orbitaaleja kukin atomi käyttää, kun elektroneja jaetaan., Esimerkiksi, kun yksinkertainen molekyyli H2 muodostuu vety-atomeja, valence bond malli sanoo, että s-orbital on yksi atomi päällekkäinen s-orbital toisaalta siteen. Tätä kuvataan joskus päällekkäisyyskaaviolla ja Kuvassa 30 esitetyllä kuvalla.

Kuva 30. Päällekkäin kaavio ja kuva valence bond kuvaus kaksiatomisen vetyä.,
Yksi ongelmista, että Pauling kohdanneet varhain hänen uraauurtavaa työtä, jossa valence-bond theory on selvästi esimerkkinä yksinkertainen valence bond kuvan liimaus veteen. Kuva 31 osoittaa, kaksi p-orbitaalit happea päällekkäisiä s-orbitaalit on vetyä. Tämä kuva osoittaa selvästi, että bond kulma veden tulisi olla 90°, koska kaksi p-orbitaalit ovat linjassa pitkin x-ja y-akselit ja ovat siis kohtisuorassa.

Kuva 31. Kehä limittäin vedessä.,
Itse asiassa, bond kulma veteen on 105° merkittävä lähtö 90°. Tällainen virhe saattaa ei näytä merkittävästi, mutta joku yrittää laatia malli, joka selittää mahdollisimman paljon tietty osa luontoa kuin mahdollista, tämä ero teorian ja kokeellisen se on hyvin kiusallinen. Pauling lisäsi teoriaan uuden muunnoksen: hybridisaation., Pauling sanoi, että atomi orbitaalit on atomi eivät ole pyhiä, ne ovat vain yksi mahdollinen joukko matemaattisia yhtälöitä (muista meidän keskustelu aalto-malli), jota voidaan käyttää kuvaamaan elektroneja, että atom. Muita sarjoja voidaan luoda lisäämällä ja vähentämällä näitä atomiorbitaaleja tiettyjen sääntöjen mukaisesti. Jos siis s-orbitaali ja kolme p-orbitaalia yhdistetään matemaattisesti, syntyy uusi orbitaalien joukko, sp3-orbitaalit. Uudet orbitaalit on eri orientational ominaisuudet kuin asetettu atomic orbitaalit., Kuvassa 32 esitetään s-ja kolme p-orbitaalia osassa (A) ja sitten osassa (b) neljä uutta sp3-hybridiä. Kuten näette, nämä sp3-hybridit suuntautuvat tetraedrin kulmiin. Kuvassa 33 esitetään, että näitä hybridejä käytetään kuvaamaan sidosta vedessä. Koska hybridien välinen kulma on 109°, odotamme nyt sidoskulman olevan vedessä 109°. Tämä antaa meille selvästi paremman yhteisymmärryksen 105 asteen kokeiluarvosta. (Huomaa, että tämä ei ole täydellinen sopimus, mutta se on parasta, mitä voimme tehdä.,) Myös muut hybridisaatioyhdistelmät ovat mahdollisia, ja ne on koottu kuvioon 34.

Kuva 32. sp3 hybridisaatio.
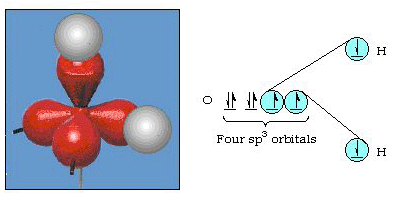
Kuva 33. Sp3-hybridien käyttö selittää sidoskulman vedessä.
Kuva 34. Muut hybridisaatiojärjestelmät.
paina videolle
Valence bond-mallissa on yksi muu ominaisuus, josta kannattaa keskustella. Sitä kuvaa hienosti tuttu happimolekyyli O2., Kuva 35 osoittaa kahden px-orbitaalin päällekkäisyyden antaakseen meille yhden sidoksen. Jos aiomme noudattaa oktettisääntöä, meidän on myös muodostettava toinen Side. Tämä on päällekkäin kaksi py tai kaksi pz-orbitaalit (sillä ei ole väliä mikä). Tämän sidoksen elektronitiheys on sisäintumarajan ylä-ja alapuolella eikä suoraan kahden happiytimen välissä. Tämä sidos on tarkoitettu 1-side, kun taas yksi, joka laittaa electron tiheys välillä atomien kutsutaan sigma (σ) bond., Yksi tämän kuvan mielenkiintoisista seurauksista on, että 1-sidoksen ennakoidaan olevan heikompi kuin sigma-sidoksen (orbitaalien päällekkäisyys on heikompi). Tämä tarkoittaa sitä, että kaksoissidos ei ole vahvuus kaksi yhden joukkovelkakirjat ja on myös enemmän alttiita hyökkäyksille ulkoinen atomit, jotka etsivät electron tiheys.

Kuva 35. Sigma-ja pi-sidosten muodostuminen diatomisessa hapessa.,
lopullinen esimerkki valence bond hoito liimaus, Kuva 36 osoittaa kuvan orbitaalit osallistuvat liimaus ethene, yksinkertaisin tyydyttymätön hiilivety (H2C=CH2). Kokeellisesti on osoitettu, että sidoskulmat jokaisen hiilen ympärillä ovat lähes 120°. Näin kuvamme näyttää sp2-hybridien käytön (koska niillä on 120° kulmaa keskenään) sigma-sidosten rakentamiseen. 1-sidos muodostuu kahden pz-orbitaalin päällekkäisyydestä. On tärkeää huomata, että 1-bond esittelee esteen kierto, hiili-hiili-sidos., Eli jos yksi CH2-ryhmä pyörisi, 1-sidos olisi rikottava, mikä vaatisi huomattavaa energiaa. Tämän seurauksena 1-sidos korjaa kaksi CH2-ryhmää yhdessä tasossa, jolloin kokonaismolekyyli on planaarinen.

Kuva 36. Sidos ethenessä.
molekyyliorbitaalimalli ottaa erilaisen lähestymistavan. Se käyttää kaikkia kaikkien atomien orbitaaleja luodakseen joukon orbitaaleja, jotka ulottuvat kaikkiin koko molekyylin atomeihin., Molekyyliorbitaalimallia on vaikeampi hahmottaa, mutta se on myös voimakkaampi. Vaikea prosessi sen määrittämiseksi, miten atomiobitaalit voidaan yhdistää molekyyliorbitaalien tuottamiseksi, tehdään nyt tietokoneella jopa suurille molekyyleille. Harjoitellaan kemisti käyttää molecular orbital malli ennustaa spectra, siirtyminen todetaan, jne., mutta arkisissa kemiallisissa keskusteluissa electron-dot-ja valence bond-mallit hallitsevat yhä päivää.
Vastaa