alataso on energia-tasolla määritelty quantum theory.Kemian, alatasoa viittaavat energiat liittyvät elektroneja.Fysiikan, alatasoa voi myös viitata energioita, jotka liittyvät ydin.,
Niels Bohr aikaisintaan quantum theory sanoi, että elektronit miehittää pallomainen kuoret keskellä on atomin ydin, kuten kaksi elektroni kuoret osoittanut, litium alla:
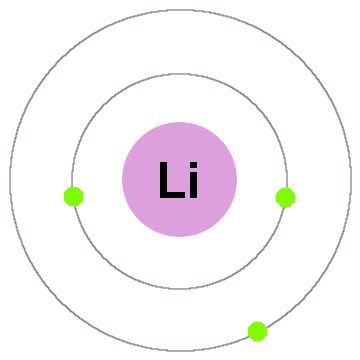
tässä vanha shell-malli liikkuvat ulospäin:
- Kuori 1 voi olla enintään 2 elektronia,
- Kuori 2 mahtuu 8 elektronia,
- Kuori 3 mahtuu 18 elektronia,
- Kuori 4 mahtuu jopa 32 elektronia,
- Kuori 5 mahtuu 50 elektroneja,…
jokainen kuori on todellisuudessa energiataso., Mitä korkeampi kuori, sitä suurempi on sen elektronin(elektronien) energia. Kaikki kuoren jakavat elektronit ovat degeneroituneita, eli niillä on saman verran energiaa.
Ennakot spektroskopia kävi ilmi, että kuoret voi todella olla subshells/alatasoa.Esimerkiksi shell 3: n elektroneilla saattaa olla eri määrä energiaa toisistaan, koska niillä on erilaisia alatasoja.
alla olevassa energiatasokaaviossa esitetään alatasot yhtä korkeiksi kuin 5F-orbitaalien energiataso.,Alatasoa oikeastaan edelleen korkeammat energiat kuin tämä, mutta 5f on sopiva paikka lähteä johdanto kuvaus.
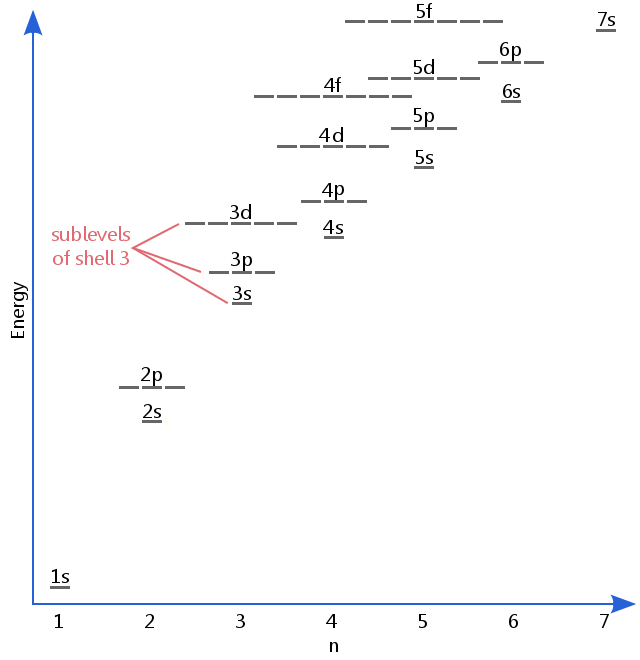

Electron alatasoa ovat tiedossa kirjaimia s, p, d, ja f.Joten, esimerkiksi, elektronit s alataso shell 3 on eri määrä energiaa elektroneja p-ja d-tasot shell 3.(Näin ei ole vedyn kohdalla., Kaikilla vedyn alatasoilla on sama energia, koska vedyllä on vain yksi elektroni.)
s, p, d, ja f alatasoa
alataso käytössä mitään electron määräytyy electron on impulssimomentti kvanttiluku l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
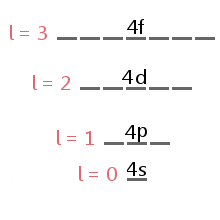
Alataso orbitaalit ovat ominaisia muotoja, jotka voidaan selittää ja ennustaa kemiallisia sidoksia, että atomit voivat muodostaa.Nämä muodot perustuvat todennäköisyyteen löytää elektroni missä tahansa tietyssä paikassa, joka kiertää ydintä.
esimerkiksi, voimme sanoa, että elektroni vety atomin 1s alataso on todettu 99 prosenttia ajasta jossain pallo tietyllä säteellä ympäri ydin.Tämä on syy, miksi voimme piirtää s-alatason orbitaalit palloksi.,
Orbitaalit korkeampi alatasoa piirretty myös sen perusteella, missä jokin atomin elektronit todennäköisimmin löytyvät. Katso lisätietoja orbitaaleista.
s-alataso on orbital
Alataso Esimerkkejä
Esimerkkejä alatasoa löytyy eri atomit ovat esitetty alla. Yläindeksi näyttää elektronien määrän kullakin alatasolla.
Vety: 1s1
Hiili: 1s2 2s2 2p2
Kloori: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
yleensä, elektronit mennä alin saatavilla energiaa alataso., Yleinen järjestys, jonka alakerrokset ovat täynnä on:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7s
Koska tämä, voimme vastata kysymyksiin kuten: ”mitä ovat kalium electron alatasoa?”
Kalium on 19 elektronia, ja me tiedämme, että s-orbitaalit pitää enintään kaksi elektronia ja p enintään kuusi. Kaliumin elektronialatasot ovat:
Vastaa