Le Groupe Carbonyle
C=O est sujet aux additions et aux attaques nucléophiles parce que la charge positive du carbone or et la charge négative de l’oxygène. La résonance de la charge positive partielle du carbone permet à la charge négative sur le nucléophile d’attaquer le groupe carbonyle et de faire partie de la structure et une charge positive (généralement un hydrogène proton) attaque l’oxygène., Juste un rappel, le nucléophile est un bon acide donc « aime les protons » donc il va attaquer le côté avec une charge positive.
Avant d’examiner en détail la réactivité des aldéhydes et des cétones, nous devons regarder en arrière et nous rappeler à quoi ressemble l’image de liaison dans un carbonyle. Les carbones carbonyles sont hybridés sp2, les trois orbitales sp2 formant des soverlaps avec des orbitales sur l’oxygène et sur les deux atomes de carbone ou d’hydrogène. Ces trois liaisons adoptent une géométrie planaire trigonale., L’orbitale 2p non hybridée restante sur le carbonyle central est perpendiculaire à ce plan et forme un pbond « côte à côte » avec une orbitale 2p sur l’oxygène.
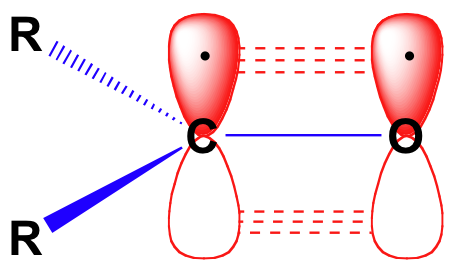
La double liaison carbone-oxygène est polaire: l’oxygène est plus électronégatif que le carbone, donc la densité électronique est plus élevée du côté oxygène de la liaison et plus faible du côté carbone. Rappelons que la polarité de liaison peut être représentée avec une flèche dipolaire, ou en montrant l’oxygène comme tenant une charge négative partielle et le carbone carbonyle une charge positive partielle.,

Une troisième façon d’illustrer le dipôle carbone-oxygène est de considérer les deux principaux contributeurs de résonance d’un groupe carbonyle: la forme majeure, qui est ce que vous voyez généralement dans les structures de Lewis, et un contributeur mineur mais très important dans lequel les deux électrons du pbond sont localisés sur l’oxygène, lui donnant une charge négative complète. Cette dernière représentation montre le carbone avec une orbitale 2p vide et une charge positive complète.
Laisser un commentaire