peu de temps après que G. N. Lewis ait popularisé le modèle électron-point, la mécanique quantique est devenue un modèle très puissant, y compris son utilisation pour décrire la liaison chimique. Deux modèles-le modèle de liaison de valence et le modèle d’orbitale moléculaire-ont été développés presque simultanément. Linus Pauling est devenu le champion du modèle de liaison de valence, plus facile à visualiser et à utiliser. Ce modèle est essentiellement une version mécanique quantique du modèle électron-point: il tente de décrire quelles orbitales sont utilisées par chaque atome lorsque les électrons sont partagés., Par exemple, lorsque la molécule simple H2 est formée à partir d’atomes d’hydrogène, le modèle de liaison de valence indique qu’une orbitale s sur un atome se chevauche avec une orbitale s sur l’autre pour former une liaison. Ceci est parfois représenté par un diagramme de chevauchement et une image comme le montre la Figure 30.

la Figure 30. Diagramme de chevauchement et image pour la description de la liaison de valence de l’hydrogène diatomique.,
L’un des problèmes que Pauling a rencontrés au début de ses efforts de pionnier avec la théorie des liaisons de valence est clairement illustré par une simple image de liaison de valence de la liaison dans l’eau. La Figure 31 montre deux orbitales p sur l’oxygène se chevauchant avec des orbitales s sur les hydrogènes. Cette image montre clairement que l’angle de liaison dans l’eau doit être de 90°, car les deux orbitales p sont alignées le long des axes x et y et sont donc perpendiculaires.

la Figure 31. Chevauchement Orbital dans l’eau.,
En fait, l’angle de liaison dans l’eau est de 105°, un écart significatif de 90°. Ce genre d’erreur peut ne pas vous sembler significatif, mais pour quelqu’un qui essaie de formuler un modèle qui expliquera autant que possible une certaine partie de la nature, cette différence entre la théorie et le fait expérimental est très gênante. Pauling a ensuite ajouté une autre modification à la théorie: l’hybridation., Pauling a dit que les orbitales atomiques sur un atome ne sont pas sacro-saintes, elles ne sont qu’un ensemble possible d’équations mathématiques (rappelez-vous notre discussion sur le modèle d’onde) qui peut être utilisé pour décrire les électrons dans cet atome. D’autres ensembles peuvent être générés en ajoutant et en soustrayant ces orbitales atomiques selon certaines règles. Ainsi, si une orbitale s et les trois orbitales p sont combinées mathématiquement, un nouvel ensemble d’orbitales, les orbitales sp3, sont générées. Le nouvel ensemble d’orbitales a différentes orientationnel des caractéristiques que l’ensemble des orbitales atomiques., La Figure 32 montre les orbitales s et P dans la partie (a), puis dans la partie (b) les quatre nouveaux hybrides sp3. Comme vous pouvez le voir, ces hybrides sp3 sont orientés vers les coins d’un tétraèdre. La Figure 33 montre que ces hybrides sont utilisés pour décrire la liaison dans l’eau. Parce que l’angle entre les hybrides est de 109°, nous nous attendons maintenant l’angle de liaison dans l’eau à 109°. De toute évidence, cela nous donne un meilleur accord avec la valeur expérimentale de 105°. (Notez que ce n’est pas en parfait accord, mais c’est le mieux que nous puissions faire.,) D’autres combinaisons d’hybridation sont également possibles, et celles-ci sont résumées à la Figure 34.

la Figure 32. hybridation sp3.
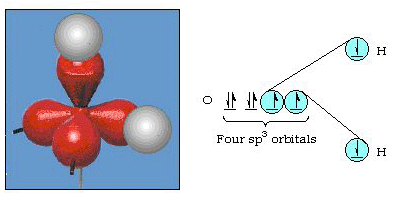
la Figure 33. L’utilisation des hybrides sp3 pour expliquer l’angle de liaison dans l’eau.
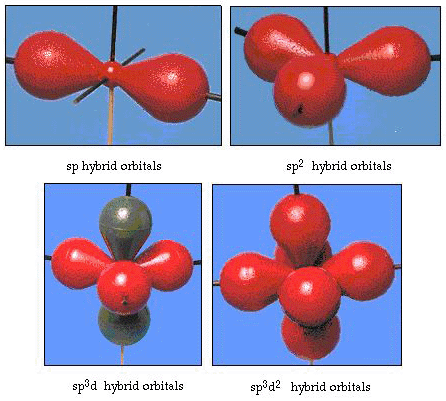
la Figure 34. Autres schémas d’hybridation.
appuyez pour la vidéo
Il y a une autre caractéristique du modèle de liaison de valence qui mérite discussion. Il est bien illustré par notre molécule d’oxygène familière, O2., La Figure 35 montre le chevauchement de deux orbitales px pour nous donner une seule liaison. Si nous devons obéir à la règle de l’Octuor, nous devons également former un autre lien. Cela doit être par chevauchement de deux orbitales py ou deux PZ (peu importe lesquelles). Cette liaison a sa densité électronique au-dessus et au-dessous de la ligne internucléaire, plutôt que directement entre les deux noyaux d’oxygène. Cette liaison est appelée une liaison 1, alors que celle qui met la densité électronique entre les atomes est appelée une liaison sigma (σ)., Une des conséquences intéressantes de cette image est que la liaison 1 devrait être plus faible que la liaison sigma (le chevauchement des orbitales est plus faible). Cela signifie qu’une double liaison n’a pas la force de deux liaisons simples et est également plus susceptible d’être attaquée par des atomes externes qui recherchent la densité électronique.

la Figure 35. Formation de liaisons sigma et pi dans l’oxygène diatomique.,
comme dernier exemple du traitement de la liaison de valence, la Figure 36 montre une image des orbitales impliquées dans la liaison dans l’éthène, l’hydrocarbure insaturé le plus simple (H2C=CH2). Expérimentalement, il a été démontré que les angles de liaison autour de chaque carbone sont de près de 120°. Ainsi, notre image montre l’utilisation d’hybrides sp2 (car ils ont des angles de 120° entre eux) pour la construction des liaisons sigma. La liaison 1 est formée par chevauchement de deux orbitales pz. Il est important de noter que la liaison 1 introduit une barrière à la rotation autour de la liaison carbone-carbone., Autrement dit, si un groupe CH2 devait tourner, la liaison 1 devrait être rompue, ce qui nécessiterait une énergie considérable. La conséquence de ceci est que la liaison 1 fixe les deux groupes CH2 dans un plan, ce qui fait que la molécule globale est plane.

la Figure 36. La liaison dans l’éthène.
Les orbitales moléculaires modèle adopte une approche différente. Il utilise tous les orbitales sur tous les atomes de générer un ensemble d’orbitales qui s’étendent sur tous les atomes de la molécule entière., Le modèle orbital moléculaire est plus difficile à visualiser, mais il est également plus puissant. Le processus difficile de déterminer comment combiner des obitals atomiques pour générer des orbitales moléculaires est maintenant fait par ordinateur pour même les grosses molécules. Le chimiste pratiquant utilise le modèle d’orbitale moléculaire pour prédire les spectres, les états de transition, etc., mais pour les discussions chimiques quotidiennes, les modèles électron-point et de liaison de valence règnent toujours.
Laisser un commentaire