Un sous-niveau est un niveau d’énergie défini par quantum theory.In chimie, les sous-niveaux se réfèrent aux énergies associées à electrons.In physique, les sous-niveaux peuvent également faire référence aux énergies associées au noyau.,
Niels Bohr premiers de la théorie quantique dit que les électrons occupent des coques sphériques centrées sur le noyau de l’atome, telles que les deux électrons indiqué pour les batteries lithium-dessous:
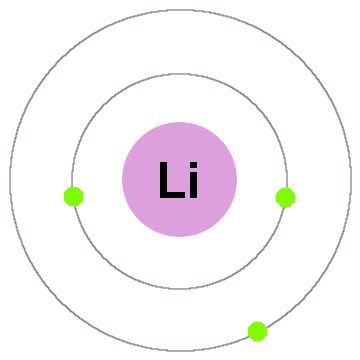
Dans cette vieille coque modèle de déplacement à l’extérieur:
- Shell 1 peut contenir jusqu’à 2 électrons,
- Shell 2 peut accueillir jusqu’à 8 électrons,
- Shell 3 peut contenir jusqu’à 18 électrons,
- Shell 4 peut contenir jusqu’à 32 électrons,
- Shell 5 peut contenir jusqu’à 50 électrons…
Chaque coque est en fait un niveau d’énergie., Plus la coque est élevée, plus l’énergie de son électron(s). Tous les électrons partageant une coquille sont dégénérés, ce qui signifie qu’ils ont la même quantité d’énergie.
Les progrès de la spectroscopie ont révélé que les coquilles peuvent en fait contenir des sous-coquilles / sous-niveaux.Les électrons de la coquille 3, par exemple, peuvent avoir des quantités d’énergie différentes les unes des autres car ils occupent des sous-niveaux différents.
Le diagramme de niveau d’énergie ci-dessous montre des sous-niveaux aussi élevés que le niveau d’énergie des orbitales 5f.,Les sous-niveaux continuent en fait à des énergies plus élevées que cela, mais 5f est un endroit approprié pour laisser une description introductive.
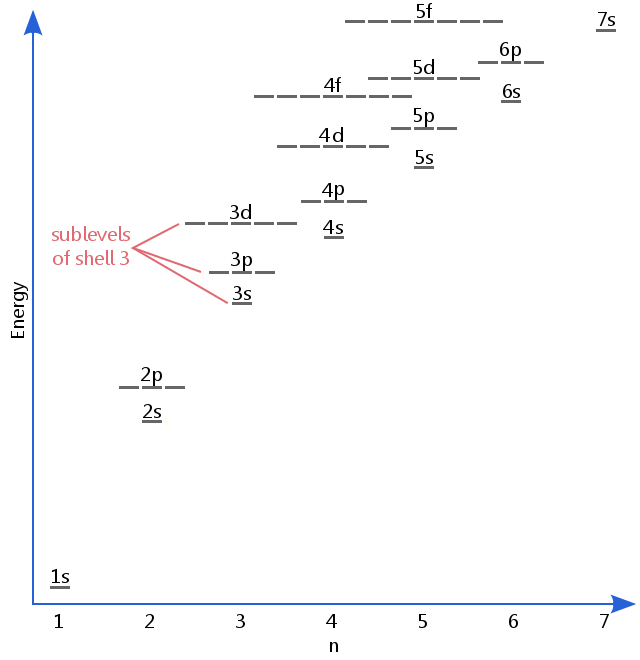

D’électrons sous-niveaux sont connus par les lettres s, p, d et f.Ainsi, par exemple, les électrons dans le sous-niveau de la coquille 3 ont une quantité différente de l’énergie des électrons dans les p et d des niveaux de shell 3.(Ce n’est pas le cas pour l’hydrogène., Tous les sous-niveaux de l’hydrogène ont la même énergie, car l’hydrogène n’a qu’un électron.)
s, p, d et f sous-niveaux
Le sous-niveau occupé par un électron est déterminé par le nombre quantique de moment angulaire de l’électron, l.,div id= »7de4153d3c »>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
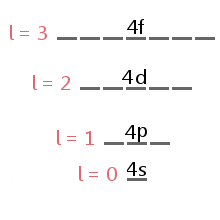
Les orbitales de sous-niveau ont des formes caractéristiques qui peuvent être utilisées pour expliquer et prédire les liaisons chimiques que les atomes peuvent former.Ces formes sont basées sur la probabilité de trouver un électron à un endroit particulier en orbite autour du noyau.
Par exemple, nous pouvons dire qu’un électron dans le sous-niveau 1s d’un atome d’hydrogène sera trouvé 99 pour cent du temps quelque part dans une sphère avec un rayon donné autour du noyau.C’est la raison pour laquelle nous pouvons dessiner les orbitales du sous-niveau s comme une sphère.,
Les orbitales pour les sous-niveaux supérieurs sont également dessinées en fonction de l’endroit où les électrons d’un atome sont les plus susceptibles d’être trouvés. Voir orbitales pour plus de détails.
Orbitale d’un sous-niveau s
Exemples de sous-niveau
Des exemples des sous-niveaux trouvés dans divers atomes sont présentés ci-dessous. L’exposant indique le nombre d’électrons dans chaque sous-niveau.
Hydrogène: 1s1
Carbone: 1s2 2s2 2p2
Chlore: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
En général, les électrons vont dans le sous-niveau d’énergie disponible le plus bas., L’ordre général dans lequel les sous-niveaux sont remplis est:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Compte tenu de cela, nous pouvons répondre à des questions comme: « quels sont les sous-niveaux d’électrons du potassium? »
Le potassium a 19 électrons, et nous savons que les orbitales s contiennent un maximum de deux électrons et p un maximum de six. Les sous-niveaux d’électrons du potassium seront:
Laisser un commentaire