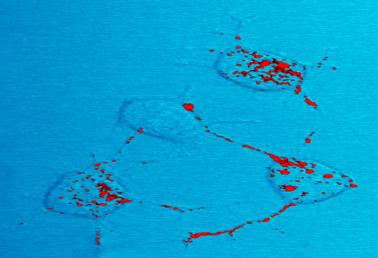
la protéine Prion, indiquée en rouge, peut devenir infectieuse et causer une maladie neurodégénérative. Ici, quatre cellules nerveuses d’une souris illustrent comment la protéine prion infectieuse se déplace à l’intérieur des cellules le long de neurites – des connexions filaires que les cellules nerveuses utilisent pour communiquer avec les cellules adjacentes.,
la protéine Prion, en rouge, peut devenir contagieux et provoquer une maladie neurodégénérative. Ici, quatre cellules nerveuses d’une souris illustrent comment la protéine prion infectieuse se déplace à l’intérieur des cellules le long de neurites – des connexions filaires que les cellules nerveuses utilisent pour communiquer avec les cellules adjacentes.
Les maladies à prions, également appelées encéphalopathies spongiformes transmissibles ou est, sont un groupe de maladies cérébrales rares et mortelles qui affectent les animaux et les humains., Ils sont causés par un agent infectieux connu sous le nom de prion, qui est dérivé d’une version mal repliée d’une protéine hôte normale connue sous le nom de protéine prion. Les maladies à prions comprennent l’encéphalopathie spongiforme bovine (ESB ou maladie de la « vache folle ») chez les bovins, la maladie de Creutzfeldt-Jakob (MCJ) et sa variante MCJ chez les humains, la tremblante chez les moutons et la maladie de dépérissement chronique (MCD) chez les cerfs, les wapitis, les orignaux et les rennes.
pourquoi L’étude des maladies à prions est-elle une priorité pour le NIAID?,
Les maladies à prions sont un problème de santé publique important et on sait qu’elles se propagent d’animaux à l’homme et, dans le cas de la variante de la maladie de Creutzfeldt-Jakob, d’humain à humain par le sang. Les maladies à prions chez les personnes sont difficiles à diagnostiquer et, lorsqu’elles sont diagnostiquées, il n’existe aucun traitement efficace disponible. En conséquence, ils sont inévitablement mortelle. Cependant, beaucoup de choses sur les maladies à prions restent inconnues et comprendre comment elles fonctionnent est important pour le développement de tests diagnostiques et de thérapies efficaces., Les maladies à prions sont également liées à d’autres maladies liées au repliement des protéines telles que la maladie d’Alzheimer, la maladie de Parkinson et la démence à corps de Lewy. Les maladies à prions sont également liées à des maladies impliquant un mauvais repliement de la protéine tau, y compris l’encéphalopathie traumatique chronique (CTE), qui est associée à des lésions cérébrales dues à des traumatismes crâniens répétés. Ainsi, la recherche sur les maladies à prions peut également aider les scientifiques à mieux comprendre d’autres maladies connexes.
comment le NIAID aborde-t-il ce sujet critique?,
Les scientifiques du NIAID examinent comment les maladies à prions se développent et se propagent entre les humains et les animaux, comment elles peuvent être diagnostiquées et comment elles peuvent être traitées. Le NIAID mène des recherches sur les maladies à prions dans ses laboratoires des montagnes Rocheuses à Hamilton, au Montana, et finance également des recherches sur les maladies à prions dans des laboratoires universitaires. Les collaborations du NIAID avec d’autres groupes des NIH qui étudient les troubles du vieillissement et les maladies neurologiques sont également importantes., Deux autres instituts des National Institutes of Health financent également la recherche sur les maladies à prions: le National Institute of Neurological Disorders and Stroke et le National Institute on Aging.
pour en savoir plus sur les facteurs de risque des maladies à prions et les stratégies actuelles de prévention et de traitement, visitez le site des Centers for Diseases Control and Prevention (CDC) sur les maladies à prions.,Test op pour les maladies cérébrales peu fréquentes
16 octobre 2019
2 août 2019
NIAID Now Blog
-
journée des maladies rares 2019—ressources et faits saillants de la recherche du NIAID
22 février 2019
biologie& génétique
les maladies à prions sont associées à la protéine prion, qui se trouve dans de nombreux tissus corporels, y compris le cerveau., Normalement, la protéine prion ne provoque pas de maladie et réside à la surface de nombreux types de cellules. Bien qu’à l’étude, les scientifiques pensent que la protéine prion normale pourrait aider à protéger le cerveau contre les dommages. Ils savent que lorsque de nombreuses molécules normales de protéines à prions changent de forme et s’agglomèrent, elles peuvent s’agréger dans le tissu cérébral et former les prions infectieux qui causent la maladie à prions. Les maladies à prions sont donc causées par une protéine à prions infectieuse, de forme anormale et agrégée. Les scientifiques ne savent pas pourquoi la protéine prion normale devient difforme., Les scientifiques du NIAID ont co-découvert le gène de la protéine prion et ont été parmi les premiers à montrer que la protéine prion anormale peut changer la protéine prion normale en une forme infectieuse anormale.
en savoir plus sur les maladies à prions biologie et génétique
approches thérapeutiques
bien qu’il n’existe aucun moyen connu de guérir les maladies à prions, des scientifiques du monde entier travaillent à développer des traitements et des diagnostics. Les chercheurs du NIAID ont mis au point un test de diagnostic rapide des maladies à prions., En utilisant des modèles d’infection à Prions en tube à essai ou à base de cellules pour un dépistage initial rapide, les chercheurs du NIAID ont également testé des milliers de composés et identifié des centaines de molécules qui inhibent la formation de la forme infectieuse anormale de la protéine prion. D’autres tests du plus puissant de ces inhibiteurs ont révélé plusieurs qui peuvent prolonger la vie des rongeurs même si le traitement commence après l’infection.,
en savoir plus sur les approches thérapeutiques pour les maladies à prions
les maladies à prions chez les animaux et les humains
il existe 3 principales maladies à prions chez les animaux: la tremblante chez les ovins, l’encéphalopathie spongiforme bovine (ESB) chez les bovins et la maladie de dépérissement chronique (MDC) chez les cerfs, les wapitis et d’autres cervidés. Les scientifiques du NIAID utilisent divers modèles expérimentaux pour étudier comment les prions d’une espèce animale peuvent infecter différentes espèces animales. Il s’agit notamment d’études visant à déterminer si des maladies animales telles que la MCD peuvent infecter des personnes et causer la maladie de Creutzfeldt-Jakob (MCJ).,
en savoir plus sur les animaux des maladies à prion et les humains
Laisser un commentaire