Pression et KMT
Les phénomènes macroscopiques de pression peuvent être expliqués en termes de théorie moléculaire cinétique des gaz. Supposons le cas dans lequel une molécule de gaz (représentée par une sphère) est dans une boîte, longueur L (Figure 1). En utilisant les hypothèses énoncées ci-dessus, et en considérant que la sphère ne se déplace que dans la direction X, nous pouvons examiner l’instance de la sphère entrant en collision élastiquement avec l’une des parois de la boîte.,
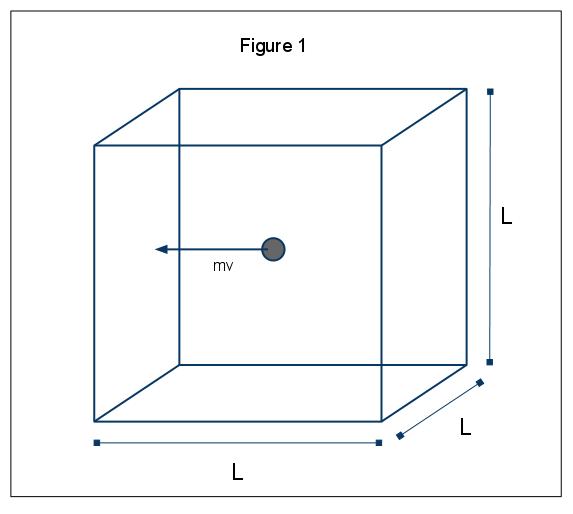
L’élan de cette collision est donnée par p=mv, dans ce cas p=mvx, puisque nous sommes à seulement compte tenu de la dimension x. Le changement d’impulsion total pour cette collision est alors donné par
\
Étant donné que le temps qu’il faut entre les collisions de la molécule avec la paroi est L/vx nous pouvons donner la fréquence des collisions de la molécule contre une paroi donnée de la boîte par unité de temps comme vx/2L., On peut maintenant résoudre la modification de l’impulsion par unité de temps:
\
la Résolution de l’impulsion par unité de temps donne la force exercée par un objet (F=ma=p/temps)., Avec l’expression que F=mvx2/L on peut maintenant résoudre pour la pression exercée par la collision moléculaire, où l’aire est donnée comme l’aire d’une paroi de la boîte, A=L2:
\
\
L’expression peut maintenant être écrite en termes de pression associée aux collisions à partir de N nombre de molécules:
\
Cette expression peut maintenant être ajustée pour tenir compte du mouvement dans les directions x, y et z en utilisant le carré moyen vitesse pour trois dimensions et une grande valeur de N., L’expression maintenant s’écrit comme:
\
Cette expression donne maintenant une pression, une qualité macroscopique, en termes de mouvement atomique. La signification de la relation ci-dessus est que la pression est proportionnelle à la vitesse moyenne au carré des molécules dans un récipient donné. Par conséquent, à mesure que la vitesse moléculaire augmente, la pression exercée sur le récipient augmente.
Laisser un commentaire