Le Méthoxyméthane a la même formule moléculaire, le même nombre d’électrons et à peu près la même forme et la même taille que l’éthanol. Malgré ces similitudes, les formules structurelles (l’organisation des molécules individuelles dans l’espace) sont différentes entre l’éthanol (CH3CH2OH) et le méthoxyméthane (CH3OCH3). Cette différence dans la configuration des atomes dans les molécules a un effet dramatique sur la volatilité de l’éthanol par rapport au méthoxyméthane.,
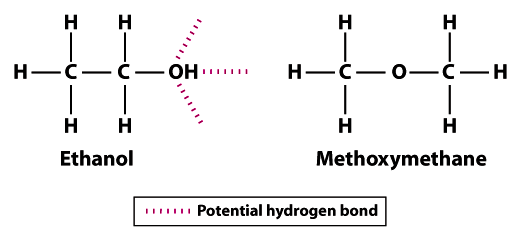 les structures montrent pourquoi l’éthanol est moins volatil que le méthoxyméthane; l’éthanol peut former trois liaisons hydrogène et le méthoxyméthane ne peut en former aucune.Notez que les atomes d’hydrogène dans le méthoxyméthane ne peuvent pas participer à la liaison hydrogène avec les atomes d’oxygène voisins. L’atome d’hydrogène du groupe hydroxyle (OH) dans l’éthanol augmente le potentiel de liaison hydrogène entre les molécules d’éthanol voisines. Comparé au méthoxyméthane, l’éthanol n’est pas aussi Volatil. Le point d’ébullition de 78,5°C pour l’éthanol est significativement plus élevé que celui de -24.,8°C pour le méthoxyméthane. Cet exemple illustre l’importance de la force de liaison en général et de la liaison hydrogène en particulier en tant que déterminant de la volatilité d’une molécule.
les structures montrent pourquoi l’éthanol est moins volatil que le méthoxyméthane; l’éthanol peut former trois liaisons hydrogène et le méthoxyméthane ne peut en former aucune.Notez que les atomes d’hydrogène dans le méthoxyméthane ne peuvent pas participer à la liaison hydrogène avec les atomes d’oxygène voisins. L’atome d’hydrogène du groupe hydroxyle (OH) dans l’éthanol augmente le potentiel de liaison hydrogène entre les molécules d’éthanol voisines. Comparé au méthoxyméthane, l’éthanol n’est pas aussi Volatil. Le point d’ébullition de 78,5°C pour l’éthanol est significativement plus élevé que celui de -24.,8°C pour le méthoxyméthane. Cet exemple illustre l’importance de la force de liaison en général et de la liaison hydrogène en particulier en tant que déterminant de la volatilité d’une molécule.
Laisser un commentaire