qu’est-ce que l’homéopathie?
L’homéopathie est une pratique médicale alternative qui a été développée à la fin des années 1700. L’homéopathie est généralement basée sur deux principes principaux:
- qu’une substance qui provoque des symptômes chez une personne en bonne santé peut être utilisée sous forme diluée pour traiter les symptômes et les maladies, un principe connu sous le nom de « like-cures-like”; Et
- plus la substance est diluée, plus elle est puissante, ce qui est connu comme la « loi des infinitésimaux., »
historiquement, les produits homéopathiques ont été identifiés grâce à des” preuves », dans lesquelles des substances sont administrées à des volontaires sains à des concentrations provoquant des symptômes. Les symptômes ressentis par les volontaires sont enregistrés pour indiquer les utilisations thérapeutiques possibles des substances. En d’autres termes, si une substance provoque un symptôme particulier, les personnes souffrant de ce symptôme seraient traitées avec une solution diluée faite à partir de cette substance.
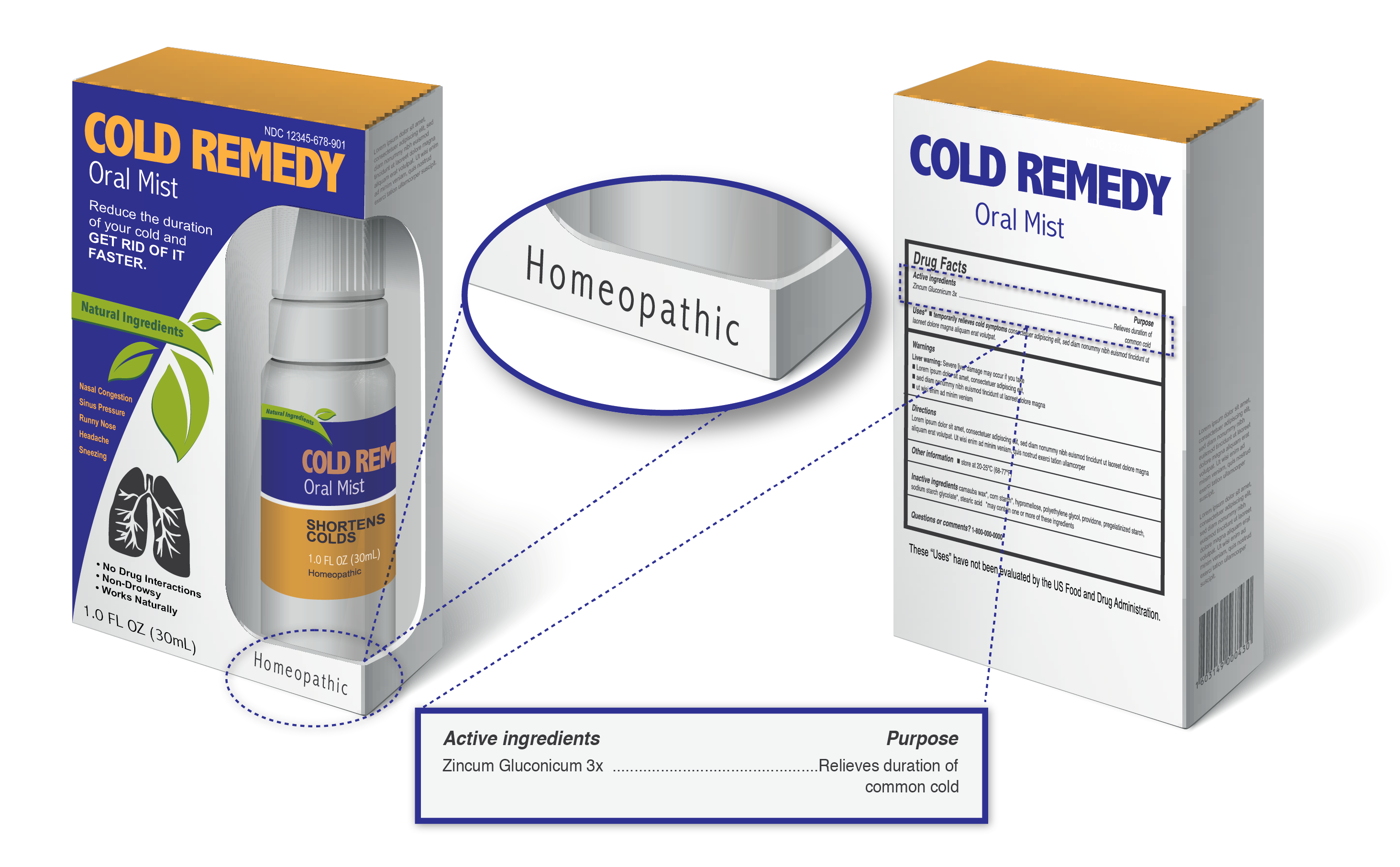
Quels sont les produits homéopathiques et comment pouvez-vous dire que vous prenez un?,
Il n’y a aucun produit approuvé PAR LA FDA étiqueté comme homéopathique; cela signifie que tout produit étiqueté comme homéopathique est commercialisé aux États-Unis sans évaluation de la FDA pour l’innocuité ou l’efficacité. Ces produits sont souvent commercialisés comme des alternatives naturelles, sûres et efficaces aux produits approuvés sur ordonnance et en vente libre, et sont vendus en ligne et dans les grands magasins de détail.
Les produits étiquetés comme homéopathiques peuvent contenir un large éventail de substances, y compris des ingrédients dérivés de plantes, de sources animales ou humaines saines ou malades, de minéraux et de produits chimiques.,
Les produits étiquetés comme homéopathiques comprennent généralement:
- Le mot « homéopathique”
- Les ingrédients énumérés en termes de dilution, par exemple 1X, 6X, 2C
retour en haut de page
la FDA est-elle préoccupée par la sécurité des produits homéopathiques?
bien que les produits étiquetés comme homéopathiques soient généralement étiquetés comme hautement dilués, certains de ces produits contiennent des quantités mesurables d’ingrédients actifs et pourraient donc causer des dommages importants aux patients., En outre, la FDA a testé des produits qui ont été mal fabriqués, ce qui peut provoquer des dilutions incorrectes et augmenter le potentiel de contamination. En outre, certains produits étiquetés comme homéopathiques sont commercialisés pour traiter des maladies ou des conditions graves.,nWide recall of homeopathic water-based medicines due to microbial contamination
que devraient savoir les consommateurs sur les produits homéopathiques?,
Les produits étiquetés comme homéopathiques et actuellement commercialisés aux États-Unis n’ont pas été examinés par la FDA pour leur innocuité et leur efficacité pour diagnostiquer, traiter, guérir, prévenir ou atténuer toute maladie ou condition. Les examens de médicaments fondés sur des preuves de la FDA jouent un rôle essentiel pour s’assurer que les médicaments sont fabriqués avec des processus de fabrication de qualité, et sont sûrs et efficaces pour les utilisations prévues., Les produits dont l’innocuité et l’efficacité n’ont pas été évaluées peuvent nuire aux consommateurs qui choisissent de traiter des maladies ou des affections graves avec de tels produits, et les consommateurs peuvent renoncer au traitement avec un produit médical dont l’innocuité et l’efficacité ont été scientifiquement prouvées.
LA FDA recommande aux consommateurs de parler à leur médecin ou professionnel de la santé des traitements sûrs et efficaces pour leur maladie ou condition.
haut de page
comment les produits homéopathiques sont-ils réglementés?,
en vertu de la Loi fédérale sur les aliments, les médicaments et les cosmétiques, les produits homéopathiques sont assujettis aux mêmes exigences en matière d’approbation, de falsification et d’étiquetage erroné que les autres produits pharmaceutiques. Il n’existe actuellement aucun produit homéopathique approuvé PAR LA FDA.
en 1988, la FDA a publié le Compliance Policy Guide (CPG) 400.400, intitulé « Conditions dans lesquelles les médicaments homéopathiques peuvent être commercialisés”, qui décrivait la Politique d’application de l’agence. Le 24 octobre 2019, la FDA a retiré CPG 400.400 parce qu’il est incompatible avec notre approche fondée sur le risque des mesures réglementaires et d’application., La FDA a également publié un projet révisé de lignes directrices: médicaments étiquetés comme homéopathiques, pour commentaires du public. Étant donné que les médicaments homéopathiques n’ont pas été approuvés par la FDA pour une utilisation, ils peuvent ne pas répondre aux normes modernes de sécurité, d’efficacité et de qualité.
Cette version révisée du guide propose une approche d’application de la loi complète et fondée sur le risque pour les produits homéopathiques commercialisés sans l’approbation de la FDA.
L’approche proposée par la FDA donne la priorité aux mesures réglementaires et d’application de la loi impliquant des produits homéopathiques non approuvés qui présentent le plus grand risque pour les patients., De nombreux produits homéopathiques ne feront probablement pas partie des catégories fondées sur le risque décrites dans la version révisée de la ligne directrice. La FDA a l’intention de concentrer ses autorités chargées de l’application de la Loi sur les types de produits suivants:
- avec des problèmes de sécurité signalés;
- qui contiennent ou prétendent contenir des ingrédients associés à des problèmes de sécurité potentiellement importants;
- pour les voies d’administration autres que par voie orale ou topique, , à utiliser en injection ou par voie nasale;
- qui prétendent traiter ou prévenir des maladies et des conditions graves et/ou potentiellement mortelles, telles que le cancer;
- commercialisé auprès de populations vulnérables, y compris les enfants, les femmes enceintes et les personnes âgées; ou
- présentant des problèmes de qualité importants.
la FDA va-t-elle retirer les produits homéopathiques du marché?
la principale préoccupation de la FDA est la sécurité des patients. Lorsque le projet de lignes directrices sera finalisé, il précisera les catégories de produits que l’agence a l’intention de prioriser pour l’application de la loi., Dans l’intervalle, avant que le projet de lignes directrices ne soit finalisé, la FDA a l’intention d’appliquer son approche générale pour hiérarchiser les mesures réglementaires et d’application fondées sur les risques.
Laisser un commentaire