a karbonilcsoport
C = O hajlamos kiegészítésekre és nukleofillikus támadásra, mert vagy a szén pozitív töltése és oxigén negatív töltése miatt. A szén részleges pozitív töltésének rezonanciája lehetővé teszi, hogy a nukleofil negatív töltése megtámadja a Karbonilcsoportot, és a szerkezet részévé váljon, a pozitív töltés (általában proton hidrogén) pedig megtámadja az oxigént., Csak egy emlékeztető, a nukleofil jó sav, ezért “szereti a protonokat”, így pozitív töltéssel támadja meg az oldalt.
mielőtt részletesen megvizsgálnánk az aldehidek és ketonok reakcióképességét, vissza kell néznünk, és emlékeztetnünk kell magunkat arra, hogy a kötési kép hogyan néz ki egy karbonilban. A karbonil-karbonok sp2 hibridizáltak, a három sp2 orbitális pályája az oxigénnel, a két szén-vagy hidrogénatommal pályákat képez. Ez a három kötés trigonális sík geometriát alkalmaz., A központi karbonil-szén fennmaradó, nem hidridizált 2P pályája merőleges erre a síkra, és “egymás melletti” pbondot képez, amelynek 2P orbitális pályája van az oxigénen.
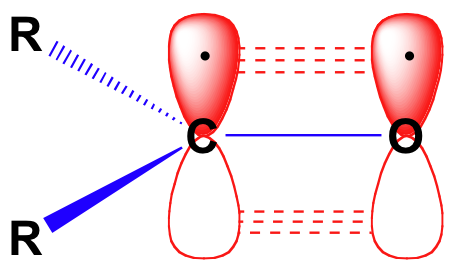
a szén-oxigén kettős kötés poláris: az oxigén elektronegatívabb, mint a szén, tehát az elektronsűrűség magasabb a kötés oxigén oldalán, és alacsonyabb a szén oldalon. Emlékezzünk arra, hogy a kötés polaritása dipól nyíllal ábrázolható, vagy az oxigén részleges negatív töltésként, a karbonil-szén pedig részleges pozitív töltésként jelenik meg.,

A harmadik út, hogy bemutassa a szén-oxigén dipól, hogy fontolja meg a két fő rezonancia közreműködők a karbonil csoport: a nagy formája, amely egy tipikus készült Lewis struktúrák, valamint egy kisebb, de nagyon fontos támogatója, amelyben mind az elektronok, a pbond vagy honosított az oxigént, így ez egy teljes negatív töltés. Ez utóbbi ábrázolás az üres 2P-s orbitális és a teljes pozitív töltésű szenet mutatja.
Vélemény, hozzászólás?