az alszint a kvantum által meghatározott energiaszint theory.In a kémia, az alszintek az alábbiakhoz kapcsolódó energiákra utalnak electrons.In a fizika, az alszintek a maghoz kapcsolódó energiákra is utalhatnak.,
Niels Bohr legkorábbi kvantum-elmélet azt mondta, hogy az elektronok elfoglalni gömb alakú kagyló középpontjában az atommag, mint például a két elektron héjak látható a lítium alábbi:
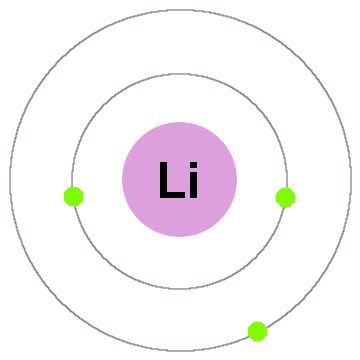
ebben A régi modell mozgó külső:
- Shell 1 legfeljebb 2 elektronok,
- Rendszerhéj-2 fér el 8 elektronok,
- Shell 3 fér el 18 elektronok,
- Shell 4 fér el a 32 elektronok,
- Shell 5 legfeljebb 50 elektronok…
Minden héj valójában energiaszint., Minél magasabb a héj, annál nagyobb az elektron(ok) energiája. A héjban osztozó összes elektron degenerált, ami azt jelenti, hogy azonos mennyiségű energiával rendelkeznek.
előlegek spektroszkópia kiderült, hogy a kagyló valóban tartalmazhat alhéj / allevelek.Az elektronok shell 3, például, lehet, hogy különböző mennyiségű energiát egymástól, mert elfoglalják a különböző alszintek.
az alábbi energiaszint diagram az alszinteket olyan magasra mutatja, mint az 5F pályák energiaszintje.,Az allevelek valójában továbbra is magasabb energiák, mint ez, de az 5f megfelelő hely a bevezető leírás elhagyására.
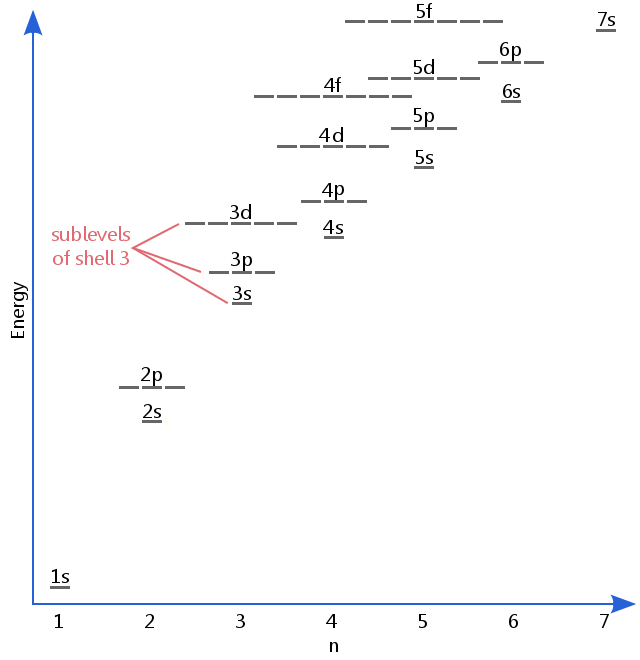

s, p, d és f allevelek
bármely elektron által elfoglalt alszintet az elektron szöglendület kvantumszáma, l határozza meg.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
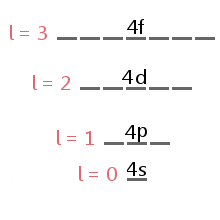
Szint elektronpályák jellemző formák is lehet magyarázni, meg lehet jósolni a kémiai kötések, hogy az atomok formájában.Ezek az alakzatok azon a valószínűségen alapulnak, hogy elektront találnak a mag körül keringő bármely adott helyen.
például azt mondhatjuk, hogy egy hidrogénatom 1S alszintjében lévő elektron az idő 99% – át valahol egy olyan gömbben találja meg, amelynek adott sugara van a mag körül.Ez az oka annak, hogy az S alszint orbitáljait gömbként vonhatjuk le.,
a magasabb alszintek pályáit is azon az alapon rajzolják, ahol az atom elektronjai valószínűleg megtalálhatók. Lásd orbitals további részletekért.
an S sublevel ‘s orbital
Sublevel példák
a különböző atomokban található allevelek példái az alábbiakban láthatók. A felső index mutatja az elektronok számát az egyes szinteken.
hidrogén: 1S1
szén: 1s2 2s2 2p2
klór: 1s2 2s2 2p6 3S2 3p5
Argon: 1s2 2s2 2p6 3S2 3P6
általában az elektronok a rendelkezésre álló legalacsonyabb energia allevelbe kerülnek., Az allevelek kitöltésének általános sorrendje:
1s 2s 2P 3S 3P 4s 3d 4P 5s 4d 5P 6s 4F 5d 6p 7s 5F 6d 7P
mivel ez, válaszolhatunk olyan kérdésekre, mint: “mi a kálium elektron allevele?”
a káliumnak 19 elektronja van, és tudjuk, hogy az S pályákon legfeljebb két elektron és P maximum hat. A kálium elektron alszintjei:
Vélemény, hozzászólás?