Tanulási Cél
- Megvitassák a tulajdonságok a nitrogén.
főbb pontok
- a nitrogén egy kémiai elem, N szimbólummal és 7 atomszámmal. Az elemi nitrogén színtelen, szagtalan, íztelen, és többnyire inert diatómikus gáz normál körülmények között, amely a Föld légkörének 78,09 százalékát teszi ki térfogat szerint.,
- A nitrogéngáz olyan ipari gáz, amelyet folyékony levegő frakcionált desztillációjával vagy mechanikus úton gáznemű levegővel állítanak elő. A kereskedelmi nitrogén gyakran a levegőfeldolgozás mellékterméke az oxigén ipari koncentrációjához.
- a Nitrogéngáznak számos alkalmazása van, beleértve a levegő inert helyettesítését, ahol az oxidáció nem kívánatos. A folyékony nitrogént a tárgyak kriogénfagyasztására is használják.
kifejezések
- elementalOf, kapcsolódó, vagy hogy egy elem (szemben a vegyület).,
- aminosaváltalában olyan molekulák, amelyek mind amino, mind karbonsav funkcionális csoportot tartalmaznak. A monomerek, amelyekből polipeptidláncok vagy fehérjék épülnek, aminosavak.
- nitrogéntartalmú kémiai elem (n jel), amelynek atomszáma 7 és atomtömege 14.0067 amu.
az elemet Daniel Rutherford skót orvos fedezte fel a levegő elválasztható összetevőjeként 1772-ben. A nitrogénvegyületek a középkorban jól ismertek voltak. Az alkimisták a salétromsavat aqua fortis (Erős víz) néven ismerték., A salétromsav és a sósav keverékét aqua regia (királyi víz) néven ismerték, amely az arany (a fémek királya) feloldódásának képességét ünnepelte. A nitrogénvegyületek legkorábbi katonai, ipari és mezőgazdasági alkalmazásai salétromot (nátrium-nitrátot vagy kálium-nitrátot) használtak, leginkább puskaporban, majd később műtrágyaként.
a nitrogén egy kémiai elem, N szimbólummal és 7-es atomszámmal. Az elemi nitrogén színtelen, szagtalan, íztelen, és többnyire inert diatómikus gáz normál körülmények között, amely a Föld légkörének 78,09 százalékát teszi ki térfogat szerint., A nitrogén a világegyetem közös eleme, galaxisunk és Naprendszerünk teljes bőségében körülbelül hetedikre becsülik. Előfordulása vélhetően teljes egészében a szupernóvák szén-és hidrogén fúziójával történő szintézisének köszönhető. Az elemi nitrogén és hidrogénnel és oxigénnel alkotott vegyületei volatilitása miatt a nitrogén sokkal kevésbé gyakori a belső Naprendszer sziklás bolygóin, és viszonylag ritka elem a Földön. A Földhöz hasonlóan azonban a nitrogén és vegyületei általában gázok formájában fordulnak elő a bolygók és holdak légkörében.,
nitrogén az élő rendszerekben
a nitrogén minden élő szervezetben előfordul, elsősorban a fehérjéket alkotó aminosavakban és nukleinsavakban (DNS és RNS). Az emberi test körülbelül három százalékos nitrogén tömeg, a negyedik leggyakoribb elem után oxigén, szén, hidrogén. A nitrogén szinte minden neurotranszmitter kémiai szerkezetében megtalálható, és meghatározó összetevője az alkaloidoknak, a számos szervezet által másodlagos metabolitként előállított biológiai molekuláknak.,
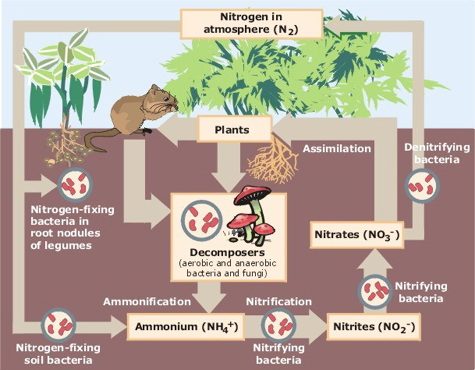
a nitrogénciklus azt írja le,hogy az elem a levegőből a bioszférába és a szerves vegyületekbe, majd vissza a légkörbe kerül. A szintetikusan előállított nitrátok az ipari műtrágyák és a vízrendszerek eutrofizációját okozó legfontosabb szennyező anyagok kulcsfontosságú összetevői.
A nitrogén ipari termelése
A nitrogéngáz egy ipari gáz, amelyet folyékony levegő frakcionált desztillációjával vagy mechanikus úton gáznemű levegővel állítanak elő (azaz nyomás alatt álló fordított ozmózis membrán vagy nyomás lengő adszorpció). A kereskedelmi nitrogén gyakran a levegőfeldolgozás mellékterméke az oxigén ipari koncentrációjához acélgyártáshoz és egyéb célokra. Amikor hengerekbe tömörítik, gyakran nevezik OFN-nek (oxigénmentes nitrogén).,
kémiai laboratóriumban ammónium-klorid vizes oldatának nátrium-nitrittel történő kezelésével vagy nátrium-azid bomlásával állítják elő:
NH_4Cl (aq) + NaNO_2 (aq) \rightarrow N_2 (g) + NaCl (aq) + 2 H_2o (l)2 NaN_3 \rightarrow 2 Na + 3 N_2
A nitrogén kémiai tulajdonságai
a nitrogén egy nemfém, elektronegativitása 3,04. Külső héjában öt elektron van, ezért a legtöbb vegyületben háromértékű. A molekuláris nitrogén (N2) hármas kötése az egyik legerősebb ismert., Az ebből eredő nehézségi konvertálni N2 más vegyületek, valamint az a könnyedség, (illetve az ehhez kapcsolódó magas energia kiadás) konvertálni a nitrogén vegyületek be elemi N2, meghatározó a szerepe a nitrogén, mind a természet valamint az emberi gazdasági tevékenységek.
Nitrogénkibocsátási spektrum
a molekuláris nitrogén (14n2) nagyrészt átlátszó az infravörös és látható sugárzásra, mivel homonukleáris molekula, ezért nincs dipól pillanata az elektromágneses sugárzás párosítására ezeken a hullámhosszokon., Jelentős abszorpció fordul elő extrém ultraibolya hullámhosszon, körülbelül 100 nanométer hullámhosszon. Ez a molekula elektronikus átmeneteihez kapcsolódik olyan állapotokhoz, amelyekben a töltés nem egyenletesen oszlik el a nitrogénatomok között. A nitrogén abszorpciója az ultraibolya sugárzás jelentős abszorpciójához vezet a föld felső légkörében és más bolygótestek légkörében.

a Nitrogén is elkészítéséhez használt minták kémiai elemzés koncentrálni, valamint csökkentse a hangerőt, folyékony minták., A folyadék felületére merőleges nyomás alatt álló nitrogéngáz-áram irányításával az oldószer elpárolog, miközben az oldott anyag(OK) t és az egyenetlen oldószert maga mögött hagyja. A nitrogén tartályok a szén-dioxidot is helyettesítik a paintball fegyverek fő energiaforrásaként. De a nitrogént nagyobb nyomáson kell tartani, mint a CO2, így az N2 tartályok nehezebbek és drágábbak.
Vélemény, hozzászólás?