nem sokkal azután, hogy G. N. Lewis népszerűsítette az electron-dot modellt, a kvantummechanika nagyon erős modell lett, beleértve annak használatát a kémiai kötés leírására. Két modellt-a valence bond modellt és a molekuláris orbitális modellt-szinte egyszerre fejlesztettek ki. Linus Pauling lett a valence bond modell bajnoka, amelyet könnyebb elképzelni és használni. Ez a modell lényegében az elektron-pont modell kvantummechanikai változata: megpróbálja leírni, hogy az egyes atomok milyen pályákat használnak az elektronok megosztásakor., Például, amikor az egyszerű H2 molekula hidrogénatomokból áll, a valence bond modell azt mondja, hogy az egyik atom s-orbitális átfedésben van egy másik s-orbitával, hogy kötést képezzen. Ezt néha átfedési diagram és a 30. ábrán látható kép ábrázolja.

30.ábra. A diatomikus hidrogén valenciakötvény-leírásának átfedési diagramja és képe.,
az egyik probléma, hogy Pauling találkozott korai úttörő erőfeszítéseit valence bond elmélet egyértelműen példázza egy egyszerű valence bond kép a kötés vízben. Ábra 31 mutatja két p-pályák oxigén átfedő s-pályák hidrogének. Ez a kép világosan mutatja, hogy a vízben a kötési szögnek 90°-nak kell lennie, mivel a két p-pálya az x és y tengely mentén helyezkedik el, ezért merőlegesek.

31.ábra. Orbitális átfedés a vízben.,
valójában a kötés szöge vízben 105°, jelentős eltérés 90° – tól. Lehet, hogy ez a fajta hiba nem tűnik számodra jelentősnek, de valaki olyan modellt próbál megfogalmazni, amely a természet egy bizonyos részének lehető legnagyobb részét magyarázza, ez az elmélet és a kísérleti tény közötti különbség nagyon zavaró. Pauling ezután újabb módosítást adott hozzá az elmélethez: a hibridizációt., Pauling azt mondta, hogy az atom atomi pályái nem sacrosanct, csak egy lehetséges matematikai egyenlet-készlet (emlékezzen a hullámmodell megvitatására), amely felhasználható az atom elektronjainak leírására. Más halmazokat úgy lehet előállítani, hogy ezeket az atomi pályákat bizonyos szabályok szerint hozzáadják és kivonják. Így, ha EGY s orbitális és a három p-orbitális kombinálódik matematikailag, akkor létrejön egy új orbitális készlet, sp3 orbitals. Az új pályák különböző orientációs jellemzőkkel rendelkeznek, mint az atomi pályák halmaza., A 32. ábra az a) részben az s és a három P-pályát, majd a B) részben a négy új sp3 hibridet mutatja. Mint látható, ezek az sp3 hibridek a tetraéder sarkai felé irányulnak. A 33. ábra azt mutatja, hogy ezeket a hibrideket használják a vízben való kötés leírására. Mivel a hibridek közötti szög 109°, most arra számítunk, hogy a vízben a kötési szög 109°. Nyilvánvaló, hogy ez jobb egyetértést ad nekünk a 105° – os kísérleti értékkel. (Figyeljük meg, hogy ez nem tökéletes egyetértés, de ez a legjobb, amit tehetünk.,) Más hibridizációs kombinációk is lehetségesek, ezeket a 34. ábra foglalja össze.

32.ábra. sp3 hibridizáció.
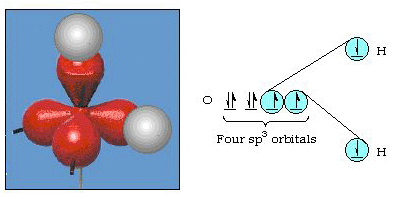
33.ábra. Sp3 hibridek használata a vízben lévő kötési szög magyarázatához.
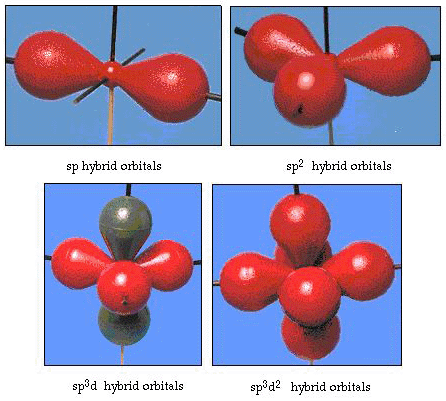
34.ábra. Egyéb hibridizációs rendszerek.
nyomja meg a videót
van egy másik jellemzője a valence bond modellnek, amely megérdemli a vitát. Jól illusztrálja ismerős oxigénmolekulánk, az O2., A 35. ábra két px-orbitális átfedését mutatja, hogy egyetlen kötést adjunk nekünk. Ha engedelmeskednünk kell az oktett-szabálynak, akkor egy másik köteléket is létre kell hoznunk. Ennek két py vagy két Pz orbitális átfedéssel kell lennie (nem számít, melyik). Ez a kötés elektronsűrűsége az internukleáris vonal felett és alatt van, nem pedig közvetlenül a két oxigénmag között. Ezt a kötést 1-kötésnek nevezzük, míg az atomok közötti elektronsűrűséget sigma (σ) kötésnek nevezzük., Ennek a képnek az egyik érdekes következménye az, hogy az 1-kötés várhatóan gyengébb lesz, mint a sigma-kötés (a pályák átfedése gyengébb). Ez azt jelenti, hogy a kettős kötés nem rendelkezik két egységes kötés erejével, és érzékenyebb az elektronsűrűséget kereső külső atomok támadására is.

35.ábra. Sigma és pi kötések kialakulása diatómiás oxigénben.,
Mint egy utolsó példa a valence bond kezelés kötés, 36. Ábra mutat egy képet az elektronpályák részt a kötés az etén, a legegyszerűbb telítetlen szénhidrogén (H2C=CH2). Kísérletileg kimutatták, hogy az egyes szén körüli kötési szögek közel 120°. Így a képünk az sp2 hibridek használatát mutatja (mert 120° – os szögek vannak egymás között) a sigma kötések építéséhez. Az 1-kötést két pz-pálya átfedése alkotja. Fontos megjegyezni, hogy az 1-kötés akadályozza a szén-szén kapcsolat forgását., Vagyis, ha egy CH2 csoport forogna, az 1-kötést meg kell szakítani, ami jelentős energiát igényel. Ennek az a következménye,hogy az 1-kötés rögzíti a két CH2 csoportot egy síkban, így a teljes molekula sík.

36.ábra. A kötés eténben.
a molekuláris orbitális modell más megközelítést alkalmaz. Az összes atom összes pályáját felhasználja, hogy olyan pályákat hozzon létre, amelyek az egész molekula összes atomjára kiterjednek., A molekuláris orbitális modellt nehezebb megjeleníteni, de erősebb is. A nehéz folyamat annak meghatározására, hogyan lehet kombinálni az atomi obitákat molekuláris pályák létrehozására, ma már számítógéppel történik még nagy molekulák számára is. A gyakorló kémikus a molekuláris orbitális modellt használja a spektrumok, az átmeneti állapotok stb. de a mindennapi kémiai vitákhoz az elektron-dot és valence bond modellek még mindig uralják a napot.
Vélemény, hozzászólás?