Non molto tempo dopo che G. N. Lewis rese popolare il modello elettrone-punto, la meccanica quantistica divenne un modello molto potente, incluso il suo uso per descrivere il legame chimico. Due modelli-il modello del legame di valenza e il modello orbitale molecolare-sono stati sviluppati quasi contemporaneamente. Linus Pauling è diventato il campione del modello di legame di valenza, che è più facile da visualizzare e utilizzare. Questo modello è essenzialmente una versione meccanica quantistica del modello elettrone-dot: tenta di descrivere quali orbitali sono usati da ciascun atomo quando gli elettroni sono condivisi., Ad esempio, quando la semplice molecola H2 è formata da atomi di idrogeno, il modello di legame di valenza dice che un orbitale s su un atomo si sovrappone con un orbitale s sull’altro per formare un legame. Questo è talvolta raffigurato da un diagramma di sovrapposizione e un’immagine come mostrato in Figura 30.

Figura 30. Schema di sovrapposizione e immagine per la descrizione del legame di valenza dell’idrogeno biatomico.,
Uno dei problemi che Pauling ha incontrato all’inizio dei suoi sforzi pionieristici con la teoria del legame di valenza è chiaramente esemplificato da una semplice immagine del legame di valenza nell’acqua. La figura 31 mostra due orbitali p su ossigeno sovrapposti con orbitali s su idrogeni. Questa immagine mostra chiaramente che l’angolo di legame in acqua dovrebbe essere di 90°, perché i due orbitali p sono allineati lungo gli assi x e y e sono quindi perpendicolari.

Figura 31. Sovrapposizione orbitale in acqua.,
Infatti, l’angolo di legame in acqua è di 105°, una partenza significativa da 90°. Questo tipo di errore potrebbe non sembrare significativo per te, ma per qualcuno che cerca di formulare un modello che spieghi il più possibile una certa parte della natura, questa differenza tra teoria e fatto sperimentale è molto fastidiosa. Pauling ha poi aggiunto un’altra modifica alla teoria hybri ibridazione., Pauling ha detto che gli orbitali atomici su un atomo non sono sacrosanti, sono solo un possibile insieme di equazioni matematiche (ricorda la nostra discussione sul modello d’onda) che possono essere usate per descrivere gli elettroni in quell’atomo. Altri insiemi possono essere generati aggiungendo e sottraendo questi orbitali atomici secondo determinate regole. Quindi, se un orbitale s e i tre orbitali p sono combinati matematicamente, viene generato un nuovo set di orbitali, gli orbitali sp3. Il nuovo insieme di orbitali ha caratteristiche orientazionali diverse rispetto all’insieme di orbitali atomici., Figura 32 mostra la s e tre p-orbitali in parte (a) e poi in parte (b) i quattro nuovi ibridi sp3. Come puoi vedere, questi ibridi sp3 sono orientati verso gli angoli di un tetraedro. Figura 33 mostra questi ibridi utilizzati per descrivere il legame in acqua. Poiché l’angolo tra gli ibridi è 109°, ora ci aspettiamo che l’angolo di legame in acqua sia 109°. Chiaramente, questo ci dà un migliore accordo con il valore sperimentale di 105°. (Si noti che questo non è in perfetto accordo, ma è il meglio che possiamo fare.,) Sono possibili anche altre combinazioni di ibridazione, e queste sono riassunte nella Figura 34.

Figura 32. ibridazione sp3.
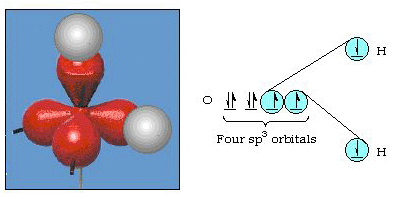
Figura 33. Uso di ibridi sp3 per spiegare l’angolo di legame in acqua.
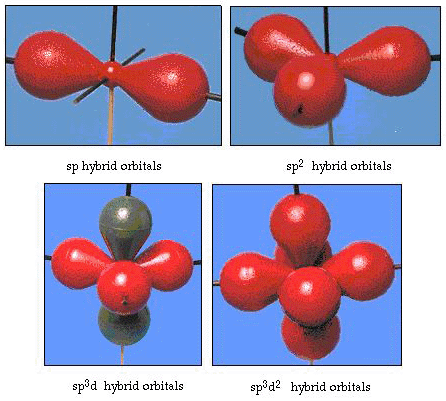
Figura 34. Altri schemi di ibridazione.
premere per il video
C’è un’altra caratteristica del modello di legame di valenza che merita discussione. È ben illustrato dalla nostra molecola di ossigeno familiare, O2., La figura 35 mostra la sovrapposizione di due orbitali px per darci un singolo legame. Se dobbiamo obbedire alla regola dell’ottetto, dobbiamo anche formare un altro legame. Questo deve essere per sovrapposizione di due orbitali py o due pz (non importa quale). Questo legame ha la sua densità elettronica sopra e sotto la linea internucleare, piuttosto che direttamente tra i due nuclei di ossigeno. Questo legame è indicato come un legame 1, mentre quello che mette la densità elettronica tra gli atomi è chiamato un legame sigma (σ)., Una delle conseguenze interessanti di questa immagine è che si prevede che il legame 1 sia più debole del legame sigma (la sovrapposizione degli orbitali è più debole). Ciò significa che un doppio legame non ha la forza di due singoli legami ed è anche più suscettibile all’attacco di atomi esterni che cercano la densità elettronica.

Figura 35. Formazione di legami sigma e pi nell’ossigeno biatomico.,
Come esempio finale del trattamento del legame di valenza del legame, la Figura 36 mostra un’immagine degli orbitali coinvolti nel legame nell’etene, il più semplice idrocarburo insaturo (H2C=CH2). Sperimentalmente, è stato dimostrato che gli angoli di legame attorno a ciascun carbonio sono quasi 120°. Quindi, la nostra immagine mostra l’uso di ibridi sp2 (perché hanno angoli di 120° tra loro) per la costruzione dei legami sigma. Il legame 1 è formato dalla sovrapposizione di due orbitali pz. È importante notare che il legame 1 introduce una barriera alla rotazione attorno al legame carbonio-carbonio., Cioè, se un gruppo CH2 dovesse ruotare, il legame 1 dovrebbe essere rotto, il che richiederebbe una notevole energia. La conseguenza di ciò è che il legame 1 fissa i due gruppi CH2 in un piano, facendo sì che la molecola complessiva sia planare.

Figura 36. Il legame con l’etene.
Il modello orbitale molecolare adotta un approccio diverso. Utilizza tutti gli orbitali su tutti gli atomi per generare un insieme di orbitali che si estendono su tutti gli atomi sull’intera molecola., Il modello orbitale molecolare è più difficile da visualizzare, ma è anche più potente. Il difficile processo di determinare come combinare gli orbitali atomici per generare orbitali molecolari è ora fatto dal computer anche per molecole di grandi dimensioni. Il chimico praticante utilizza il modello orbitale molecolare per prevedere spettri, stati di transizione, ecc., ma per discussioni chimiche quotidiane, i modelli di legame di elettrone-punto e valenza ancora governano il giorno.
Lascia un commento