Un sottolivello è un livello di energia definito da quantum theory.In chimica, i sottolivelli si riferiscono alle energie associate a electrons.In fisica, i sottolivelli possono anche riferirsi alle energie associate al nucleo.,
Niels Bohr primi teoria quantistica ha detto che gli elettroni occupano sferica conchiglie centrata sul nucleo atomico, come i due gusci degli elettroni indicato per batterie al litio di seguito:
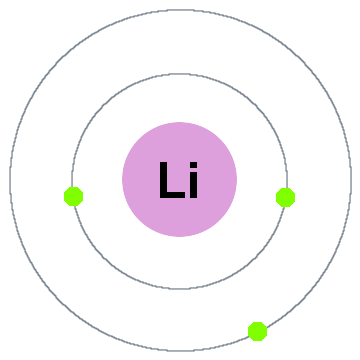
In questo vecchio modello shell, spostandosi verso l’esterno:
- Guscio 1 può contenere fino a 2 elettroni,
- Shell 2 può ospitare fino a 8 elettroni,
- Shell 3 può contenere fino a 18 elettroni,
- Guscio 4 può contenere fino a 32 elettroni,
- Shell 5 può contenere fino a 50 elettroni…
Ogni shell è in realtà un livello di energia., Più alto è il guscio, maggiore è l’energia dei suoi elettroni. Tutti gli elettroni che condividono un guscio sono degenerati, il che significa che hanno la stessa quantità di energia.
I progressi della spettroscopia hanno rivelato che le shell possono effettivamente contenere subshell / sottolivelli.Gli elettroni nel guscio 3, ad esempio, potrebbero avere quantità diverse di energia l’una dall’altra perché occupano diversi sottolivelli.
Il diagramma del livello di energia qui sotto mostra i sottolivelli fino al livello di energia degli orbitali 5f.,I sottolivelli in realtà continuano a energie più elevate di questa, ma 5f è un luogo adatto per lasciare una descrizione introduttiva.
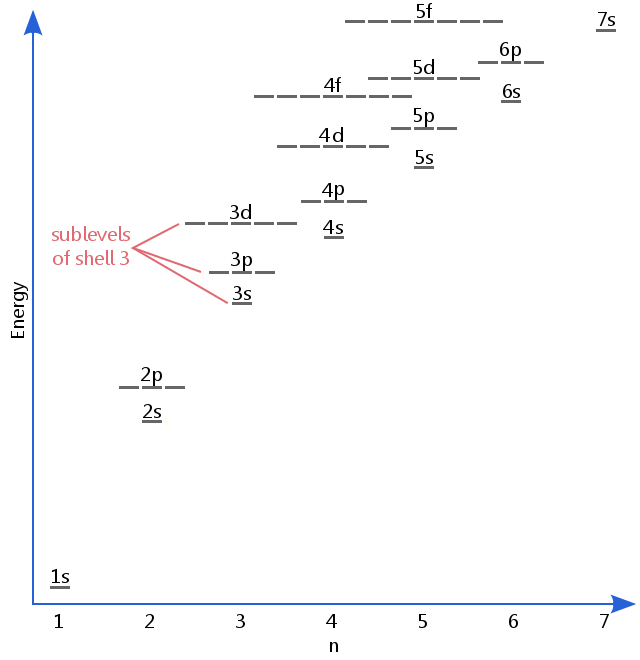

Elettrone sottolivelli sono noti con le lettere s, p, d, e, f.Così, per esempio, gli elettroni nel sottolivello s di shell 3 hanno una diversa quantità di energia dagli elettroni nel p e d i livelli di shell 3.(Questo non è il caso per l’idrogeno., Tutti i sottolivelli dell’idrogeno hanno la stessa energia, perché l’idrogeno ha solo un elettrone.)
s, p, d e f sottolivelli
Il sottolivello occupato da qualsiasi elettrone è determinato dal numero quantico del momento angolare dell’elettrone, l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
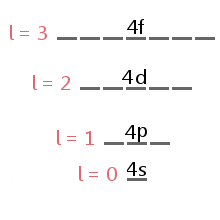
Gli orbitali sottolivello hanno forme caratteristiche che possono essere utilizzate per spiegare e prevedere i legami chimici che gli atomi possono formare.Queste forme si basano sulla probabilità di trovare un elettrone in una particolare posizione in orbita attorno al nucleo.
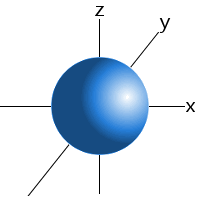
Ad esempio, possiamo dire che un elettrone nel sottolivello 1s di un atomo di idrogeno si troverà il 99% del tempo da qualche parte in una sfera con un dato raggio attorno al nucleo.Questo è il motivo per cui possiamo disegnare gli orbitali del sottolivello s come una sfera.,
Gli orbitali per i sottolivelli più alti sono anche disegnati sulla base di dove è più probabile che si trovino gli elettroni di un atomo. Vedi orbitali per maggiori dettagli.
Orbitale di un s sottolivello
Esempi di sottolivello
Esempi dei sottolivelli trovati in vari atomi sono mostrati di seguito. L’apice mostra il numero di elettroni in ogni sottolivello.
Idrogeno: 1s1
Carbonio: 1s2 2s2 2p2
Cloro: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
In generale, gli elettroni entrano nel sottolivello di energia più basso disponibile., L’ordine generale in cui vengono riempiti i sottolivelli è:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Detto questo, possiamo rispondere a domande come: “quali sono i sottolivelli elettronici di potassio?”
Il potassio ha 19 elettroni, e sappiamo che gli orbitali s contengono un massimo di due elettroni e p un massimo di sei. I sottolivelli di elettroni del potassio saranno:
Lascia un commento