FOTOBIOLOGIA della LENTE UMANA
Joan E. Roberts
la Fordham University, Dipartimento di Scienze Naturali
113 Ovest 60th Street, New York City, NY 10023
Introduzione
La funzione primaria dell’umano obiettivo è mettere a fuoco la luce non distorte sulla retina. Mentre le proprietà di trasmissione della maggior parte dei componenti dell’occhio sono stabili, le proprietà di trasmissione della lente cambiano per tutta la vita, come si vede nella Figura 1.,
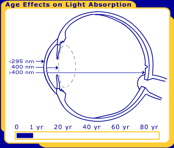
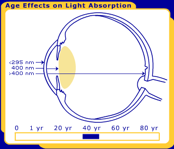
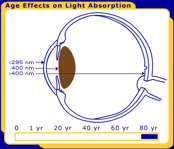
Figura 1. I cambiamenti nella lente umana per tutta la vita. Nella foto sono alla nascita, 40 anni e 80 anni.
L’esposizione alla luce intensa del sole può rappresentare un pericolo particolare per la lente dell’occhio e portare alla formazione di una cataratta, che compromette la visione., Sia l’esposizione UV-A che UV-B sono i principali fattori di rischio per l’induzione di una cataratta, specialmente in quelli sopra i 70 anni, perché con l’età la capacità dell’occhio di proteggersi dai danni della luce è compromessa. L’esposizione alle radiazioni UV dal riflesso di acqua, sabbia o neve è particolarmente dannosa per la lente dell’occhio .Oltre alla sola radiazione UV, ci sono molti coloranti, farmaci e farmaci a base di erbe che in presenza di luce visibile e radiazioni UV possono indurre una cataratta . Questa reazione fototossica provoca una cataratta molto precoce .,
Qualsiasi modifica nella chiarezza della lente degraderà la qualità dell’immagine presentata alla retina e influisce notevolmente sulla percezione visiva. In questo modulo, impareremo a conoscere la fotochimica e la fotobiologia della lente e come queste proprietà influenzano non solo la retina, ma la salute umana generale .
Struttura della parte anteriore dell’occhio (Segmento anteriore)
L’occhio umano è composto da diversi compartimenti, come si vede in Figura 2. Lo strato più esterno contiene la sclera, la cui funzione è quella di proteggere il bulbo oculare, e la cornea, che concentra la luce in entrata sulla lente., Sotto questo strato è la coroide contenente l’iride, che è noto come uvea. Questa regione contiene melanociti, che contengono il pigmento melanina, la cui funzione è quella di prevenire la dispersione della luce. L’apertura nell’iride, la pupilla, si espande e si contrae per controllare la quantità di luce in arrivo. L’iride e la lente sono immersi nell’umore acqueo. L’umore acqueo è un fluido che funge da sistema circolatorio trasparente (ciò che il flusso sanguigno fa nei tessuti non trasparenti)., Non solo mantiene la pressione intraoculare, ma fornisce anche nutrimento alla lente e alla cornea e rimuove detriti e rifiuti da questi tessuti oculari. L’umore acqueo contiene alte concentrazioni di vari antiossidanti. L’obiettivo è posizionato dietro l’iride. La funzione dell’obiettivo è di mettere a fuoco la luce senza distorsioni sulla retina, che si trova nella parte posteriore dell’occhio (segmento posteriore) .

Figura 2. La struttura dell’occhio umano.,
La struttura della lente umana
La struttura della lente umana è visibile in Figura 3. L’obiettivo è un organo trasparente situato dietro la cornea e l’iride . Il bordo esterno della lente è costituito da un singolo strato di cellule epiteliali e da una membrana che copre l’intero organo . Le cellule epiteliali della lente non si dividono tranne quando sono in fase di riparazione. Alcune cellule epiteliali perdono i loro nuclei e altri organelli e diventano cellule di fibre lente . Queste cellule della fibra della lente sono riempite con una soluzione di 30% della proteina, conosciuta come proteina della lente del cytosol (solubile)., Poiché c’è poco turnover proteico nelle cellule della fibra della lente, il danno alla proteina della lente si accumula per tutta la vita.

Figura 3. La struttura della lente umana.
Sutura ed Equatore sono termini anatomici in oftalmologia. Sutura significa le cuciture della lente. I modelli di sutura diventano più complessi come più strati di fibre della lente vengono aggiunti alla porzione esterna della lente. Equatore indica il bordo della porzione più grande della lente (simile all’equatore su un globo).,
Quando la luce è dannosa per l’obiettivo umano?
Sebbene la luce ambientale sia per lo più benigna, ci sono diverse condizioni in cui l’esposizione alla luce ambientale diventa dannosa. Per determinare se la luce è dannosa, si devono considerare i seguenti fattori: intensità, lunghezza d’onda, sito di danno, tensione dell’ossigeno, cromofori, sistemi di difesa e meccanismi di riparazione.
Intensità. Maggiore è l’intensità della luce, più è probabile che danneggi l’occhio. La luce che normalmente non può essere dannosa può causare danni acuti se è sufficientemente intensa., Ad esempio, è ben noto che l’occhio può essere danneggiato (temporaneamente o permanentemente) dall’esposizione alla luce solare riflettente dalla neve (cecità da neve) o dal fissare il sole durante un’eclissi . C’è un aumento delle radiazioni UV con un assottigliamento dello strato di ozono protettivo . Allo stesso modo, l’occhio può sostenere danni da fonti di luce artificiale che emettono UV-A o UV-B . Il danno cumulativo della luce deriva da un’esposizione meno intensa per un periodo di tempo più lungo ed è spesso il risultato di una perdita di protezione correlata all’età sottostante .
Lunghezza d’onda., La radiazione ambientale, proveniente dal sole o da fonti di luce artificiale, contiene quantità variabili di luce UV-C (100-280 nm), UV-B (280-315 nm), UV-A (315-400 nm) e visibile (400-700 nm). Più breve è la lunghezza d’onda, maggiore è l’energia e quindi maggiore è il potenziale di danno biologico. Tuttavia, anche se le lunghezze d’onda più lunghe sono meno energiche, penetrano l’occhio più profondamente .
Affinché si verifichi una reazione fotochimica, la luce deve essere assorbita in un particolare tessuto oculare., Il primate / occhio umano ha caratteristiche di filtraggio uniche che determinano in quale area dell’occhio ogni lunghezza d’onda della luce sarà assorbita. La radiazione UV inferiore a 295 nm viene filtrata dal raggiungimento della lente dalla cornea umana. Ciò significa che le lunghezze d’onda più brevi e più energetiche della luce (tutte le UV-C e alcune UV-B) vengono filtrate prima che raggiungano la lente umana. La maggior parte della luce UV viene assorbita dall’obiettivo, ma l’esatta gamma di lunghezze d’onda dipende dall’età. Negli adulti, la lente assorbe i restanti UV-B e tutti gli UV-A (295-400 nm), e quindi solo la luce visibile raggiunge la retina., Tuttavia, la lente umana molto giovane trasmette una piccola finestra di luce UV-B (320 nm) alla retina, mentre la lente anziana filtra gran parte della luce visibile blu corta (400-500 nm). La trasmissione differisce anche con le specie; le lenti dei mammiferi diversi dai primati trasmettono radiazioni UV più lunghe di 295 nm alla retina .
Sito di luce danni alla lente. La lente è composta da due parti che sono più suscettibili ai danni: le cellule epiteliali (esterne) e la membrana di fibra (interna). Le cellule epiteliali controllano il trasporto verso l’obiettivo., Hanno un contatto diretto con l’umore acqueo e sono più vulnerabili ai danni fototossici. Il danno a queste cellule comprometterebbe facilmente la vitalità della lente . La membrana in fibra può essere danneggiata fotochimicamente attraverso danni ai lipidi e / o alla principale proteina intrinseca della membrana .
Le reazioni fototossiche possono portare ad una modificazione del DNA e di alcuni amminoacidi (istidina, triptofano, cisteina) e/o ad un attaccamento covalente del sensibilizzatore alle proteine del cristallino del citosol ., I cromofori legati covalentemente possono quindi agire come sensibilizzatori endogeni e produrre una sensibilità prolungata alla luce. Inoltre, vi è una modifica non fotochimicamente indotta delle proteine della lente associate al diabete . Un’alta concentrazione di glucosio è stata trovata per condurre alla glicosilazione dei gruppi epsilon-amminici dei residui della lisina. Tutti questi tipi di danni si tradurranno in un cambiamento nell’indice di rifrazione del materiale della lente, portando all’aggregazione e infine all’opacizzazione (catarattogenesi) ., Una tecnica recentemente sviluppata (ScanTox) misura i cambiamenti molto precoci nella qualità ottica (messa a fuoco) della lente, anche prima che il danno causi l’opacizzazione della lente .
Cromofori. Un cromoforo è una sostanza che assorbe la luce. Un cromoforo oculare può essere un composto endogeno naturalmente presente nell’occhio, o un agente esogeno che è passato attraverso le barriere sangue-oculari e penetrato in un particolare sito. Affinché la luce danneggi la lente, la luce deve prima essere assorbita da un cromoforo situato in qualche compartimento della lente.,
a) Cromofori endogeni (presenti in natura) nella lente umana. I cromofori nella lente umana cambiano per tutta la vita come si vede nella figura 4a e b. In realtà c’è poco danno all’occhio umano dalla luce prima della mezza età. Questo perché la lente umana adulta contiene cromofori gialli (3-idrossichiurenine) che assorbono la luce, ma rilasciano l’energia prima che abbia la possibilità di fare danni ., Quindi i cromofori di chinurenina presenti nella lente umana adulta non solo sono sicuri, ma servono a proteggere la retina filtrando le radiazioni UV, impedendole così di raggiungere e danneggiare la retina . Dopo la mezza età un enzima (chinurenina amino transferasi), prodotto in quantità crescenti, converte i cromofori protettivi (3-OH chinurenina e il suo glucoside) in cromofori distruttivi, acido xanturenico e glucoside xanturenico . Quando questi composti xanturenici assorbono la luce, producono specie reattive dell’ossigeno (ossigeno singoletto e/o superossido) , che danneggiano le proteine della lente ., Un altro cromoforo, la N-formil chinurenina, formata dalla continua fotoossidazione del triptofano endogeno, produce anche ossigeno singoletto e superossido, che danneggiano le proteine della lente . Pertanto, l’acido xanturenico e la N-formil chinurenina sono probabili candidati per i cromofori responsabili della formazione della cataratta legata all’età.

Figura 4a. Cambiamenti legati all’età nella lente umana. Man mano che la lente invecchia, i cromofori cambiano il colore dell’occhio umano da chiaro (al centro) a giallo (in alto a destra)., Come risultato dei cambiamenti di invecchiamento nella lente umana si verifica un annebbiamento della lente, che è noto come cataratta (in alto a sinistra). Le lenti di mucca (in basso) e altri non primati hanno lenti chiare per tutta la vita.
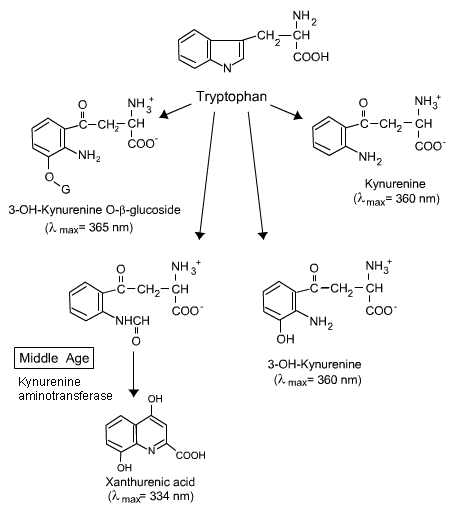
Figura 4b. Il cambiamento dei derivati del triptofano nella lente umana con età. Nota il cambiamento alla mezza età. Per ulteriori informazioni, vedere il testo sopra.
b) Xenobiotici o cromofori esogeni nella lente., Le radiazioni UV-B o UV-A intense o accumulate causano danni diretti alla lente umana. Tuttavia, in presenza di una luce attivata (fotosensibilizzata) farmaco, farmaci a base di erbe, (ipericina in erba di San Giovanni) o nanoparticelle, i pazienti sono in pericolo di lesioni oculari potenziate da radiazioni UV ambientali e luce visibile ., La misura in cui una particolare sostanza chimica è in grado di produrre effetti collaterali fototossici nell’occhio dipende da diversi parametri tra cui: 1) la struttura chimica; 2) gli spettri di assorbimento del farmaco; 3) legame del farmaco al tessuto oculare; e 4) la capacità di attraversare le barriere sangue-oculari.
Qualsiasi composto che abbia una struttura ad anello triciclico, eterociclico o porfirinico è un cromoforo oculare potenziale se ha assorbanza al di sopra del taglio della cornea (>295 nm). Quando questi sensibilizzatori esogeni (esterni) si legano ai tessuti oculari (es.,, proteine della lente), il loro tempo di conservazione nella lente è esteso ed il pericolo potenziale che pongono è migliorato. Le sostanze anfifiliche o lipofile sono in grado di attraversare la maggior parte delle barriere lenticolari . La lente è alimentata dall’umore acqueo ed è relativamente difficile per una sostanza passare attraverso l’umore acqueo alla lente per ingestione. Tuttavia, una volta nell’obiettivo, è anche difficile rimuovere la sostanza estranea.
Tensione di ossigeno. La tensione dell’ossigeno nell’obiettivo è molto bassa ,ma è sufficiente per la fotoossidazione.
Sistemi di difesa., L’obiettivo ha un sistema di difesa molto efficiente contro la luce e danni da radiazioni. La lente contiene enzimi antiossidanti (superossido dismutasi (SOD) e catalasi) e antiossidanti (Vitamina E, C, luteina, glutatione) che servono a proteggerlo dai danni ossidativi e fotoindotti . Sfortunatamente, la maggior parte di questi antiossidanti e enzimi protettivi diminuisce a partire dai quarant’anni di età , lasciando la lente indifesa contro i danni della luce.
Riparazione., Le cellule epiteliali della lente periferica sono in grado di riparare i legami incrociati del DNA indotti da UV-B (dimeri di pirimidina ciclobutano e 6-4 pirimidina-pirimidone) , ma qualsiasi ulteriore esposizione a UV-A interferisce con la riparazione cellulare. Poiché c’è poco turnover delle proteine della lente, il danno alle proteine della lente acumula .
Meccanismo di luce danni alla lente
Fotoossidazione. La luce intensa può indurre danni diretti al DNA, ma con una luce meno intensa, l’occhio viene danneggiato attraverso una reazione di fototossizzazione., Nelle reazioni di fotoossidazione, un cromoforo nell’occhio assorbe la luce e ossida alcuni aminoacidi e / o acidi nucleici, causando danni all’intera lente. Il cromoforo può essere endogeno (naturale) o esogeno (farmaco, farmaco a base di erbe o nanoparticelle che si è accumulato nell’occhio). L’assorbimento della luce eccita il cromoforo in uno stato di singoletto eccitato, che subisce quindi un incrocio intersistemico e raggiunge lo stato di tripletta., Nel suo stato di tripletta, il cromoforo procede quindi tramite un meccanismo di tipo I (radicale libero) o di tipo II (ossigeno singoletto) per causare il danno finale . La fotoossidazione può avvenire nell’obiettivo mediante un meccanismo di tipo I o di tipo II o entrambi contemporaneamente.
I cromofori è la lente umana adulta possono essere eccitati dalla luce, ma scendono da questo stato eccitato (singoletto) molto rapidamente (nanosecondi), quindi non hanno la possibilità di raggiungere uno stato di tripletta, di fare intermedi attivi dannosi, e quindi di causare danni nella lente ., Tuttavia, quando i fotosensibilizzatori efficienti, l’acido xanturenico, il glucoside e la N-formil chinurenina sono presenti nella lente e la lente è esposta alle radiazioni UV, sono in grado di realizzare triplette con efficienza sufficiente (rendimento quantico) per formare specie reattive dell’ossigeno e radicali liberi, che a loro volta danneggiano il tessuto della lente.
Cataratta
Meccanismo di induzione. La lente umana è normalmente trasparente fino all’età di 40 anni. Questa trasparenza è il risultato della disposizione ordinata delle fibre proteiche nella lente normalmente ., A mezza età, la protezione enzimatica e antiossidante naturale dell’occhio contro UV-A e UV-B si perde allo stesso tempo c’è un aumento della produzione di cromofori fotochimicamente attivi. Poiché la lente assorbe la luce ambientale, questi cromofori sono fotoattivati e producono specie reattive dell’ossigeno, come l’ossigeno singoletto e il superossido. Le proteine della lente (alfa, beta, cristalline gamma) diventano denaturate o le cellule epiteliali della lente non possono più riparare i danni dalla luce ambientale ., All’età di 70 anni, la lente diventa finalmente sufficientemente torbida da ostruire la vista e si dice che l’individuo abbia una cataratta legata all’età (Figura 4a) .
La cataratta può anche svilupparsi in età molto precoce quando la persona è esposta a radiazioni UV eccessive, fumo di sigaretta e inquinamento atmosferico, farmaci fotosensibilizzanti, steroidi o diabete. La causa sottostante di queste cataratte è anche il danno ossidativo (e fotossidativo) alle cellule epiteliali della lente e alle proteine della lente.,
Il mantenimento dell’integrità strutturale è particolarmente importante per la proteina lente alfa-cristallina a causa del suo ruolo di chaperone molecolare. l’alfa-cristallina è un aggregato di due polipeptidi, A e B, che sono piccole proteine da shock termico che impediscono l’aggregazione proteica indotta da UV (A e B). Aggiungendo e rimuovendo la produzione di alfa-cristallina dalle cellule epiteliali della lente, Andley ha dimostrato che l’alfa-cristallina conferisce una protezione naturale contro i danni da radiazioni UV alle cellule della lente . l’alfa-cristallina protegge anche dall’inibizione UV-A dell’attività enzimatica protettiva (catalasi)., I siti specifici di danno all’alfa-cristallina con cromofori sia endogeni che esogeni sono stati rilevati utilizzando tecniche di spettrometria di massa e anticorpi monoclonali . I prodotti finali avanzati della glicazione trovati in cataratta diabetica possono anche comportarsi come fotosensibilizzatori e ossidare le proteine della lente .
Tutte le ossidazioni endogene o esogene denaturano le proteine della lente, riducono la loro solubilità e, infine, provocano una perdita di trasparenza nella lente, che è nota come cataratta., Una cataratta che si verifica nella parte centrale della lente è nota come cataratta nucleare e quelle che si verificano nella periferia della lente sono note come cataratta corticale. Una forma più rara di cataratta è nota come cataratta subcapsulare posteriore. Questa cataratta è generalmente pensato per essere geneticamente collegato, e si verifica alla nascita o in età molto precoce, o come risultato di uso di steroidi o diabete .
Diagnosi e trattamento., La cataratta può essere facilmente diagnosticata con l’uso di una “lampada a fessura” o di un oftalmoscopio, che esamina la lente per mancanza di trasparenza e determina la posizione e la densità dell’annebbiamento. Inoltre, un test dell’acuità visiva determinerà quanto bene il paziente può vedere con la cataratta. Quando si nota una significativa perdita della vista, il trattamento consiste nel rimuovere chirurgicamente l’obiettivo. Questa lente è comunemente sostituita con una lente di plastica intraoculare contenente un filtro UV-A e UV-B, per sostituire la messa a fuoco e il potere filtrante perso dalla rimozione della lente della cataratta ., Recentemente, le lenti artificiali intraoculari sono state disponibili con filtri di luce blu corti (400-440 nm), che sono importanti per proteggere gli anziani dalla degenerazione maculare e il diabetico dalla retinopatia diabetica .
Prevenzione. Se si impedisce alla luce di eccitare i cromofori endogeni o esogeni nella lente, o si blocca il danno delle specie reattive dell’ossigeno con antiossidanti, si può prevenire o ritardare la formazione della cataratta .
a) Occhiali da sole. Sia UV-A che UV-B non sono necessari né per la vista né per innescare la risposta circadiana., D’altra parte, sia UV-A che UV-B inducono la formazione della cataratta. La rimozione di queste lunghezze d’onda dall’esposizione oculare ridurrà notevolmente il rischio di formazione precoce della cataratta. Questo può essere fatto facilmente indossando occhiali da sole che bloccano lunghezze d’onda inferiori a 400 nm . Tuttavia, a causa della geometria dell’occhio questi occhiali devono essere occhiali da sole avvolgenti per evitare che le radiazioni UV riflettenti raggiungano l’occhio.
b) Antiossidanti Poiché l’età diminuisce la normale produzione di antiossidanti nella lente , aumentando il mangiare frutta e verdura è stato suggerito di sostituire la protezione mancante ., Inoltre, l’integrazione con vitamine e antiossidanti, tra cui vitamina E e luteina, ha dimostrato di essere particolarmente efficace nel ritardare la cataratta legata all’età .
Gli integratori devono essere bilanciati, perché possono verificarsi reazioni di ossidazione dannose se viene assunto un solo antiossidante . Nell’AREDS (Age-Related Eye Disease Study) sponsorizzato dal National Eye Institute, è stato riscontrato che un eccessivo beta-carotene era collegato ad un aumentato rischio di cancro ai polmoni per i fumatori, mentre un eccessivo Zn era collegato ad un aumentato rischio di cancro alla prostata., Poiché la luteina, non il beta-carotene, è il carotenoide naturale che si trova nella lente e nella retina , l’integrazione con beta-carotene eccessivo non è solo inutile per proteggere l’occhio, ma è pericolosa per i fumatori e gli ex fumatori. Altri prodotti naturali come il tè verde, che contiene polifenoli (epigallocatechina gallato) e Ashwagandha (radice di Withania somnifera) utilizzato nella medicina ayurvedica tradizionale è stato anche dimostrato di ritardare luce indotta danni alla lente .
Conclusioni
La formazione della cataratta è una malattia legata all’età. La maggior parte delle persone formerà una cataratta quando avranno 70 anni., Sia UV-A che UV-B sono fattori di rischio molto importanti per lo sviluppo della cataratta precoce. Inoltre, l’esposizione alla luce visibile anche in presenza di steroidi, farmaci fotosensibilizzanti, cosmetici e nanoparticelle può aumentare drasticamente il rischio di cataratta precoce. Evitare le radiazioni UV con occhiali da sole appropriati e l’appropriata combinazione di integratori antiossidanti ossidanti e riducenti può aiutare a ritardare o eliminare questo disturbo accecante negli anziani.
Andley UP (2008) L’epitelio cristallino: focus sull’espressione e la funzione degli accompagnatori alfa-cristallini., Int J Biochem Cell Biol. 40:317-23.
Andley UP (2007) Cristalline nell’occhio: funzione e patologia. Prog Retin Eye Res. 26:78-98.
Andley U P, Rhim JS , Chylack Jr LT, Fleming TP (1994) Propagazione e immortalizzazione delle cellule epiteliali lente umana, Invest. Oftalmolo. Vis. Sic., 35:3094-3102.
Andley UP, Patel HC, Xi JH, Bai F (2004) Identificazione di geni sensibili alle radiazioni UV-A nelle cellule epiteliali lente umana utilizzando microarray cDNA. Fotochem. Fotobiolo. 80, 61-71.,
Andley UP, Song Z, Mitchell DL (1999) Riparazione del DNA e sopravvivenza nelle cellule epiteliali lente umana con durata della vita estesa. Curr Eye Res. 18:224-30.
Argirov OK, Lin B, Ortwerth BJ (2004) 2-ammonion – 6-(3-ossidopiridinio-1-il) esanoato (OP-lisina) è un prodotto finale di glicazione avanzata recentemente identificato in lenti umane catarattose e invecchiate. J. Biol. Chimica. 279:6487-6495.
Argirova MD, Breipohl W (2002) Le proteine glicate possono migliorare lo stress fotoossidativo nelle lenti invecchiate e diabetiche. Radic gratis. Res. 36:1251-1259.,
Ayala MN, Michael R, Soderberg PG (2000) Influenza del tempo di esposizione per la cataratta indotta da radiazioni UV Invest Ophthalmol Vis Sci. 41: 3539-43. Bachem, A. (1956) Spettri di azione oftalmica. Essere. J. Ophthalmol. 41: 969-975.
Balasubramanian D (2000) Radiazioni ultraviolette e cataratta. J. Farmacol oculare. Therap. 16, 285-297.
Balasubramanian D (2005) Fotodinamica della cataratta: un aggiornamento sui cromofori endogeni e antiossidanti. Fotochem. Fotobiolo. 81:498-501.
Benedek GB (1971) Teoria della trasparenza dell’occhio. Appl. Ottica 10:459-473.,
Bochow TW, West SK, Azar A, Munoz B, Sommer A, Taylor H R(1989) Esposizione alla luce ultravioletta e rischio di cataratta subcapsulare posteriorearch. Oftalmologia 107: 369-372.
Barker, FM, Brainard GC e Dayhaw-Barker P (1991) Trasmittanza della lente umana in funzione dell’età. Investire. Oftalmolo. Vis. Sic. 32S pag. 1083.
Bassnett S e Mataic D (1997) Degradazione della cromatina nel differenziare le cellule della fibra della lente dell’occhio J. Cell Biol. 137: 37-49.,
Busch M, Gorgels TG, Roberts JE, van Norren D (1999) Gli effetti di due stereoisomeri di N-acetilcisteina sul danno fotochimico da UVA e luce blu nella retina di ratto. Fotochem. Fotobiolo. 70:353-358.
Coroneo MT (1990) Concentrazione di albedo nell’occhio anteriore: un fenomeno che individua alcune malattie solari. Oftalmico. Chirurgia 21: 6066.
Dillon J e Atherton SJ (1990) Tempo risolto studi spettroscopici sulla lente umana intatta. Fotochem. Fotobiolo. 51 :465-468.
Dillon J (199) Fotofisica e fotobiologia dell’occhio. J. Fotochem.Fotobiolo. B BioI. 10:23-40.,
Dovrat A, Sivak JG (2005) Sistema di coltura dell’organo della lente a lungo termine con un metodo per il monitoraggio della qualità ottica dell’obiettivo. Photochem Photobiol. 81:502-505.
Edge R, Land EJ, McGarvey DJ, Mulroy L, Truscott TG (1998) Potenziali di riduzione relativi di un elettrone dei cationi radicali carotenoidi e le interazioni dei carotenoidi con il catione radicale della vitamina E. J. Am. Chimica. Soc. 120:4087-4090.
Edge R, McGarvey DJ, Truscott TG (1997) I carotenoidi come antiossidanti-una recensione. J. Fotochem. Fotobiolo. B: Biol. 41:189-200.
Falkner-Radler CI, Benesch T, Binder S., (2008) Lenti intraoculari con filtro a luce blu in vitrectomia combinata con chirurgia della cataratta: risultati di una clinica controllata randomizzata trial.Am Ophthalmol. 145:499-503.
Finley EL, Dillon J, Crouch RK, Schey KL (1998). Identificazione dei prodotti del triptofano nell’alfa-cristallina bovina di ossidazione. Proteina Sic., 7:2391-2397.
Finley EL, Dillon J, Crouch RK, Schey KL (1998) Ossidazione indotta dalla radiolisi dell’alfa-cristallina bovina. Fotochem. Fotobiolo. 68:9-15.
Finley EL, Busman M, Dillon J, Crouch RK, Schey KL (1997) Identificazione di siti di fotoossidazione in alfa-cristallina bovina., Fotochem. Fotobiolo. 66:635-641.
Giblin FJ (2000) Glutatione: un antiossidante vitale della lente. J. Ocul. Pharmacol. Ther. 16: 121-135.
Horwitz J, Zigman S (1997) Gli alfa-cristallini proteggono la catalasi dai danni UV? Biol Bull. 193:254-255.
Jacques PF, Chylack LT Jr, Hankinson SE, Khu PM, Rogers G, Friend J, Tung W, Wolfe JK, Padhye N, Willett WC, Taylor A. (2001) Assunzione di nutrienti a lungo termine e opacità delle lenti nucleari legate all’età precoce. Arco oftalmolo. 119:1009-1019.,
Khachik F, Bernstein PS, Garland DL (1997) Identificazione dei prodotti di ossidazione della luteina e della zeaxantina nelle retine umane e delle scimmie. Investire. Oftalmolo. Vis. Sic. 38 pp. 1802-1811.
Krishna CM, Uppuluri S, Riesz P, Zigler Jr JS, Balasubramanian D (1991) Uno studio delle efficienze fotodinamiche di alcuni costituenti delle lenti oculari. Fotochem. Fotobiolo. 54:51-58.
Kuszak JR, Peterson KL, Sivak JG, Herbert KL. (1994) The interrelationship of lens anatomy and optical quality. II. Lenti primate. Scad. Occhio Res. 59:521-35.,
Kwan M, Niinikoske J, Hunt TK (1971) Tensione dell’ossigeno nell’acqua e nella lente. Investire. Oftalmolo. 11:108-111.
Lyle BJ, Mares-Perlman JA, Klein BE, Klein R, Greger JL (1999) Assunzione di antiossidanti e rischio di incidenti legati all’età cataratta nucleare nello studio Beaver Dam Eye. Essere. J. Epidemiol. 149:801-809.
Malina HZ, Martin XD (1996) La formazione di derivati dell’acido xanturenico nella lente è responsabile della cataratta senile negli esseri umani. Graefes Arch. Clin. Scad.Ophth., 234: 723-730
McLaren JW, Dinslage S, Dillon JP, Roberts JE, Brubaker RF (1999) Misurazione della tensione dell’ossigeno nella camera anteriore dei conigli. Investire. Oftalmolo. Vis. Sic. 39:1899-1909.
Merriam JC (1996) La concentrazione di luce nella lente umana. Trans.Am. Oftalmolo. Soc. 94: 803-918.
Norval M, Cullen AP, de Gruijl FR, Longstreth J, Takizawa Y, Lucas RM, Noonan FP, van der Leun JC . (2007). Gli effetti sulla salute umana derivanti dalla riduzione dell’ozono stratosferico e le sue interazioni con i cambiamenti climatici. Photochem Photobiol Sci. 6:232-51.,
Olmedilla B, Granado, F, Blanco I, Vaquero M (2003) Luteina, ma non alfa-tocoferolo, l’integrazione migliora la funzione visiva nei pazienti con cataratta legata all’età: uno studio pilota in doppio cieco controllato con placebo di 2 anni. Nutrizione 19, 21-24.
Roberts JE (2008) “Fototossicità oculare indotta da farmaci” In: Dermatotossicologia di Marzulli e Maibach, 7a edizione, a cura di H. Zhai, K-P Wilhelm e H. Maibach, Capitolo 28, pp 269-278. Taylor & Francis Group, Boca Raton, Florida.
Roberts JE, Wielgus AR, Boyes WK, Andley U, Chignell CF., (2008) Phototoxicity and cytotoxicity of fullerol in human lens epithelial cells. Toxicology and Applied Pharm 228:49-58.
Roberts JE (2002) Screening for Ocular Phototoxicity. International Journal of Toxicology 21:491-500.
Roberts JE, Finley EL, Patat SA, Schey K L (2001) Photooxidation of Lens Proteins with Xanthurenic Acid: A Putative Chromophore for Cataractogenesis. Photochem. Photobiol. 74: 740-744.
Roberts JE. (2001) Ocular phototoxicity. J. Photochem. Photobiol. B: Biology 64, 136-143.,
Roberts JE, Wishart JF, Martinez L Chignell CF (2000) Studi fotochimici sull’acido xanturenico. Fotochem. Fotobiolo. 72: 467471.
Roberts JE (2000) Luce e immunomodulazione. NY Acad Sci. 917:435-445.
Roberts JE, Roy D, Dillon J (1985) L’ossidazione fotosensibilizzata della proteina intrinseca principale della lente del vitello (MP26) con ematoporfirina. Curr. Occhio Res. 4:l8l-185.
Rodriguez-Galietero A, Montes-Mico R, Munoz G, Albarran-Diego C.(2005) Lente intraoculare filtrante a luce blu in pazienti con diabete: sensibilità al contrasto e discriminazione cromatica. J Chirurgia refrattaria della cataratta., 31:2088-2092.
Samiec PS, Drews-Botsch C, Flagge EW, Kurtz JC, Sternberg P, Reed RL Jones DP (1998) Il glutatione nel plasma umano diminuisce in associazione con l’invecchiamento, la degenerazione maculare legata all’età e il diabete. Radic gratis. Biol. Med. 24:699-704.
Schalch W e Chylack LT Jr, (2003) micronutrienti antiossidanti e cataratta. revisione e confronto degli studi AREDS e REACT cataract. Oftalmologo 100, 181-189.
Schey KL, Little M, Fowler JG, Crouch RK (2000) Caratterizzazione della struttura proteica intrinseca principale della lente umana, Invest. Ophthal. Vis Sic., 41 175-182.,
Schey KL, Patat S, Chignell CF, Datillo M, Wang RH, Roberts JE (2000) Fotoossidazione delle proteine della lente da parte dell’ipericina (principio attivo nell’erba di San Giovanni). Fotochem. Fotobiolo. 72:200-207.
Seth RK, Kharb S (1999) Funzione protettiva dell’Alfa-tocoferolo contro il processo di catarattogenesi nell’uomo. Ann. Nutr. Metab. 43: 286-289.
Sliney DH (2007) Commento : Trasmissione spettrale di IOL espresso come un’era virtuale. Br J Ophthalmol. 91:1261-1262.
Sliney DH (2005) La geometria dell’esposizione e l’ambiente spettrale determinano gli effetti fotobiologici sull’occhio umano. Photochem Photobiol., 81:483-489.
Sliney, D. H. (1997) Sicurezza delle radiazioni ottiche delle sorgenti luminose medicali. Phys. Med. Biol. 42:981-996.
Straight R, Spikes JD (1985) Ossidazione fotosensibilizzata di biomolecole. In: O. Singlet, Editore, A. A. Frimer, Editore, Polimeri e biopolimeri Vol. IV, CRC Press, Boca Raton, FL, pp. 91-143.
Staniszewska MM, Nagaraj RH. (2005) modifica mediata da 3-idrossicinurenina delle proteine della lente umana: determinazione della struttura di una modifica principale utilizzando un anticorpo monoclonale. J Biol Chem. 280:22154-64.,
Thiagarajan G, Venu T, Balasubramanian D (2003) Si avvicina per alleviare il peso della cecità della cataratta attraverso antiossidanti naturali: uso di Ashwagandha (Withania somnifera). Curr. Sic. 85, 1065-1071.
Thiagarajan G, Shirao E, Ando K, Inoue A, Balasubramanian D (2002) Ruolo dell’acido xanturenico 8-O-beta-glucoside, un nuovo fluoroforo che si accumula nella lente dell’occhio umano brunescente. Fotochem. Fotobiolo. 76, 368-372.
van Norren D, van de Kraats J. (2007) Trasmissione spettrale di lenti intraoculari espresse come un’età virtuale. Br J Ophthalmol; 91: 1374-1375.,
Yeum KJ, Shang FM, Schalch WM, Russell RM, Taylor A (1999) Concentrazioni di nutrienti liposolubili in diversi strati di lente cataratta umana. Curr.Occhio Res. 19: 502-505.
Zigman S, McDaniel T, Schultz J, Reddan J (2000) Effetti dell’esposizione intermittente ai raggi UVA sulle cellule epiteliali delle lenti coltivate. Curr Eye Res. 20:95-100.
Zigman S, Rafferty NS, Rafferty KA, Lewis N (1999) Effetti dei polifenoli del tè verdedi polifenoli del tè verde sullo stress fotoossidativo dell’obiettivo. Biol-Bull. 197: 285-286.
Zigman S (2000) Lente UVA fotobiologia. Ocul Pharmacol Ther. 16:161-165.
Lascia un commento