Il metossimetano ha la stessa formula molecolare, lo stesso numero di elettroni e approssimativamente la stessa forma e dimensione dell’etanolo. Nonostante queste somiglianze, le formule strutturali (l’organizzazione delle singole molecole nello spazio) sono diverse tra etanolo (CH3CH2OH) e metossimetano (CH3OCH3). Questa differenza nella configurazione degli atomi all’interno delle molecole ha un effetto drammatico sulla volatilità dell’etanolo rispetto al metossimetano.,
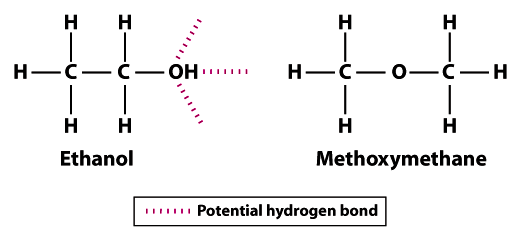 Le strutture mostrano perché l’etanolo è meno volatile del metossimetano; l’etanolo può formare tre legami idrogeno e il metossimetano non può formarne nessuno.Si noti che gli atomi di idrogeno nel metossimetano non possono partecipare al legame dell’idrogeno con gli atomi di ossigeno vicini. L’atomo di idrogeno del gruppo idrossile (OH) in etanolo aumenta il potenziale di legame dell’idrogeno tra le molecole di etanolo vicine. Rispetto al metossimetano, l’etanolo non è così volatile. Il punto di ebollizione di 78,5°C per l’etanolo è significativamente più alto rispetto a -24.,8°C per il metossimetano. Questo esempio illustra il significato della forza di legame in generale e del legame dell’idrogeno in particolare come determinante della volatilità di una molecola.
Le strutture mostrano perché l’etanolo è meno volatile del metossimetano; l’etanolo può formare tre legami idrogeno e il metossimetano non può formarne nessuno.Si noti che gli atomi di idrogeno nel metossimetano non possono partecipare al legame dell’idrogeno con gli atomi di ossigeno vicini. L’atomo di idrogeno del gruppo idrossile (OH) in etanolo aumenta il potenziale di legame dell’idrogeno tra le molecole di etanolo vicine. Rispetto al metossimetano, l’etanolo non è così volatile. Il punto di ebollizione di 78,5°C per l’etanolo è significativamente più alto rispetto a -24.,8°C per il metossimetano. Questo esempio illustra il significato della forza di legame in generale e del legame dell’idrogeno in particolare come determinante della volatilità di una molecola.
Lascia un commento