Che cosa è l’omeopatia?
l’Omeopatia è una medicina alternativa pratica che è stato sviluppato alla fine del 1700. L’omeopatia si basa generalmente su due principi fondamentali:
- una sostanza che provoca i sintomi in una persona sana può essere utilizzato in forma diluita per il trattamento di sintomi e malattie, un principio noto come “come-cure-like”; e
- il più diluito sostanza, il più potente è, che è conosciuta come la “legge di infinitesimi.,”
Storicamente, i prodotti omeopatici sono stati identificati attraverso “provings”, in cui le sostanze vengono somministrate a volontari sani in concentrazioni che causano sintomi. I sintomi sperimentati dai volontari sono registrati per indicare possibili usi terapeutici per le sostanze. In altre parole, se una sostanza causa un particolare sintomo, gli individui che sperimentano quel sintomo sarebbero trattati con una soluzione diluita a base di quella sostanza.
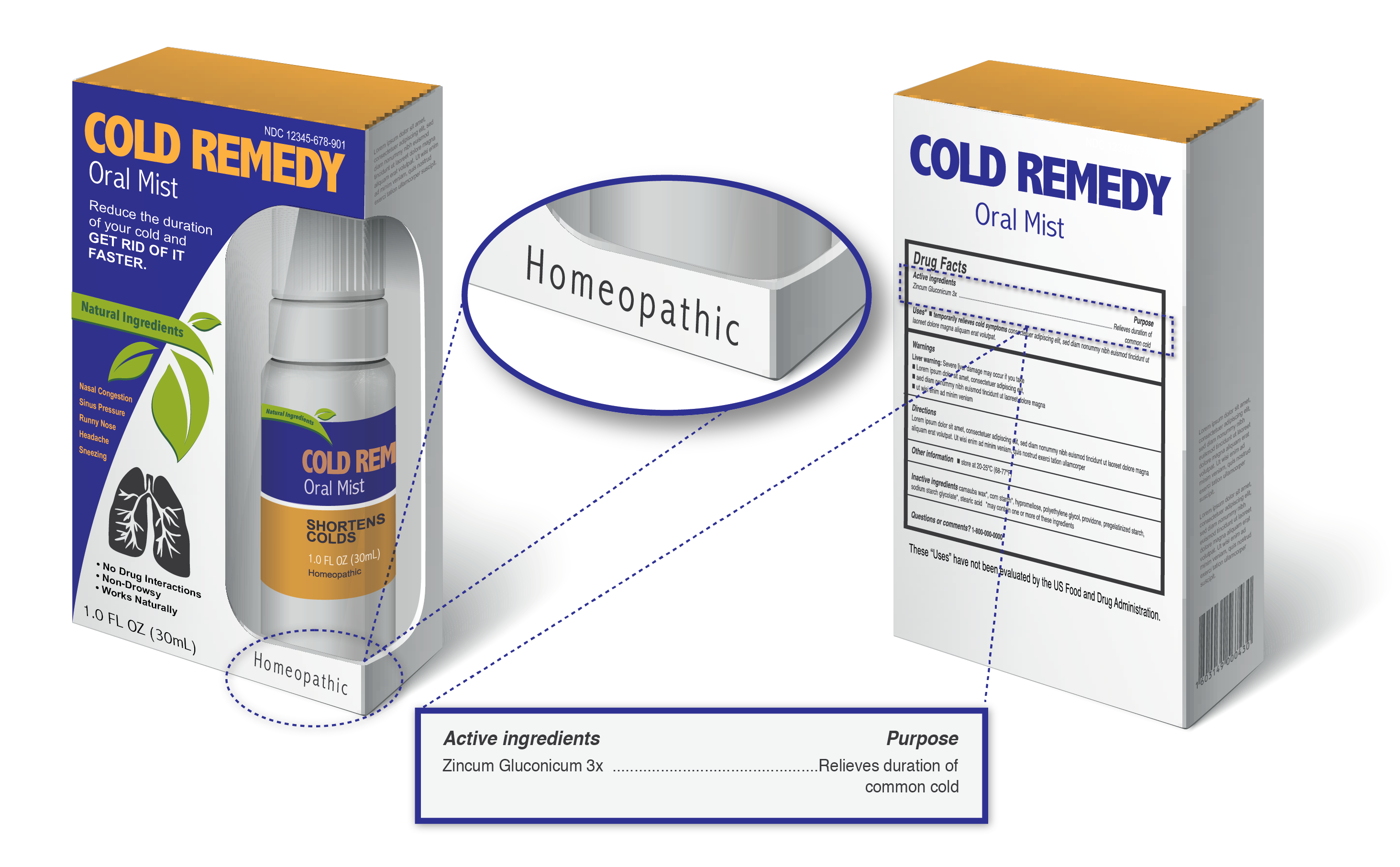
Che cosa sono i prodotti omeopatici e come potete dire che state prendendo uno?,
Non ci sono prodotti approvati dalla FDA etichettati come omeopatici; ciò significa che qualsiasi prodotto etichettato come omeopatico viene commercializzato negli Stati Uniti senza valutazione FDA per la sicurezza o l’efficacia. Questi prodotti sono spesso commercializzati come alternative naturali, sicure ed efficaci ai prodotti approvati di prescrizione e senza prescrizione medica e sono venduti online e nei principali negozi al dettaglio.
I prodotti etichettati come omeopatici possono contenere una vasta gamma di sostanze, inclusi ingredienti derivati da piante, fonti animali o umane sane o malate, minerali e sostanze chimiche.,
i Prodotti etichettati come omeopatica generalmente includono:
- La parola “Omeopatia”
- Gli ingredienti elencati in termini di diluizione, ad esempio 1X, 6X, 2C
Torna all’inizio
FDA preoccupati per la sicurezza di prodotti omeopatici?
Mentre i prodotti etichettati come omeopatici sono generalmente etichettati come altamente diluiti, alcuni di questi prodotti sono stati trovati per contenere quantità misurabili di principi attivi e quindi potrebbero causare danni significativi al paziente., Inoltre, la FDA ha testato prodotti fabbricati in modo improprio, che possono causare diluizioni errate e aumentare il potenziale di contaminazione. Inoltre, alcuni prodotti etichettati come omeopatici sono commercializzati per trattare malattie o condizioni gravi.,nwide ricordare omeopatico a base di acqua farmaci a causa della contaminazione microbica
Quello che i consumatori dovrebbero sapere circa i prodotti omeopatici?,
I prodotti etichettati come omeopatici e attualmente commercializzati negli Stati Uniti non sono stati esaminati dalla FDA per la sicurezza e l’efficacia per diagnosticare, trattare, curare, prevenire o mitigare eventuali malattie o condizioni. Le revisioni dei farmaci basate sull’evidenza della FDA svolgono un ruolo essenziale nel garantire che i farmaci siano realizzati con processi di produzione di qualità e siano sicuri ed efficaci per gli usi previsti., I prodotti che non sono stati valutati per la sicurezza e l’efficacia possono danneggiare i consumatori che scelgono di trattare malattie o condizioni gravi con tali prodotti e i consumatori possono rinunciare al trattamento con un prodotto medico che è stato scientificamente dimostrato di essere sicuro ed efficace.
FDA raccomanda ai consumatori di parlare con il proprio medico o operatore sanitario circa trattamenti sicuri ed efficaci per la loro malattia o condizione.
Torna su
Come vengono regolamentati i prodotti omeopatici?,
Ai sensi del Federal Food, Drug, and Cosmetic Act, i prodotti omeopatici sono soggetti agli stessi requisiti relativi all’approvazione, all’adulterazione e al misbranding di altri prodotti farmaceutici. Attualmente non ci sono prodotti omeopatici approvati dalla FDA.
Nel 1988, la FDA ha pubblicato Compliance Policy Guide (CPG) 400.400, intitolato “Condizioni in cui i farmaci omeopatici possono essere commercializzati”, che ha descritto la politica di applicazione dell’agenzia. In ottobre 24, 2019, FDA ha ritirato CPG 400.400 perché non è coerente con il nostro approccio basato sul rischio all’azione normativa e di applicazione., FDA ha anche emesso una bozza di guida riveduta: prodotti farmaceutici etichettati come omeopatici, per un commento pubblico. Poiché i prodotti omeopatici della droga non sono stati approvati da FDA per tutto l’uso, non possono soddisfare le norme moderne per sicurezza, l’efficacia e la qualità.
Questa bozza di guida riveduta propone un approccio di applicazione completo e basato sul rischio per i prodotti omeopatici commercializzati senza l’approvazione della FDA.
L’approccio proposto dalla FDA dà la priorità alle azioni normative e di applicazione che coinvolgono prodotti omeopatici non approvati che rappresentano il maggior rischio per i pazienti., Molti prodotti omeopatici probabilmente non rientrano nelle categorie basate sul rischio descritte nella bozza di guida riveduta. La FDA intende concentrare le sue autorità di controllo sui seguenti tipi di prodotti:
- con problemi di sicurezza segnalati;
- che contengono o pretendono di contenere ingredienti associati a problemi di sicurezza potenzialmente significativi;
- per vie di somministrazione diverse da quelle orali o topiche, ad esempio, da utilizzare come iniezione o per via nasale;
- che pretendono di trattare o prevenire malattie e condizioni gravi e/o pericolose per la vita, come il cancro;
- commercializzato a popolazioni vulnerabili, inclusi bambini, donne incinte e anziani; o
- con problemi di qualità significativi.
La FDA rimuoverà i prodotti omeopatici dal mercato?
La preoccupazione principale della FDA è la sicurezza del paziente. Quando il progetto di orientamento è finalizzato, specificherà le categorie di prodotti che l’agenzia intende dare la priorità per l’applicazione., Nel frattempo, prima che il progetto di guida sia finalizzato, la FDA intende applicare il suo approccio generale alla priorità delle azioni normative e di applicazione basate sul rischio.
Lascia un commento