De Karbonyl Gruppe
C=O er utsatt for tilføyelser og nucleophillic angrepet på grunn eller karbon er positiv ladning og oksygen er negativt ladet. Resonans av karbon delvis positiv ladning kan den negative ladningen på nucleophile å angripe Karbonyl gruppe og bli en del av strukturen, og en positiv ladning (vanligvis en proton hydrogen) angrep oksygen., Bare en påminnelse, den nucleophile er en god syre derfor «liker protoner» så det vil angripe den siden med en positiv ladning.
Før vi vurdere i detalj reaktivitet av aldehyder og ketoner, vi trenger å se tilbake og minne oss selv på hva bonding bildet ser ut i en karbonyl. Karbonyl karbonatomer er sp2 hybridiserte, med tre sp2 orbitals forming soverlaps med orbitals på oksygen, og på de to karbon eller hydrogen atomer. Disse tre obligasjoner vedta trigonal plan geometri., De resterende ikke-hybridisert 2p orbital på den sentrale karbonyl karbon er vinkelrett på dette flyet, og danner et «side-ved-side’ pbond med en 2p orbital på oksygen.
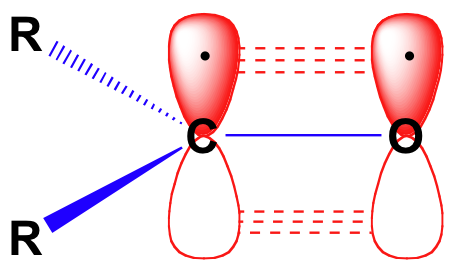
karbon-oksygen dobbeltbindingen er polar: oksygen er mer electronegative enn karbon, så electron tettheten er høyere på oksygen siden av bond og lavere på karbon side. Husker at bond polaritet kan være avbildet med en dipol pil, eller ved å vise oksygen som holder en delvis negativ ladning og karbonyl karbon delvis positiv ladning.,

En tredje måte å illustrere karbon og oksygen dipol er å vurdere de to viktigste resonans bidragsytere av en karbonyl gruppe: viktige form, som er hva du vanligvis se trukket i Lewis strukturer, og en liten, men veldig viktig bidragsyter der både elektroner i pbond er lokalisert på oksygen, noe som gir det en full negativ ladning. Sistnevnte skildring viser karbon med en tom 2p orbital og en full positiv ladning.
Legg igjen en kommentar