Methoxymethane har samme molekylær formel, samme antall elektroner, og omtrent samme form og størrelse som etanol. Til tross for disse likhetene, strukturelle formler (organiseringen av den enkelte molekyler i verdensrommet) er forskjellig mellom etanol (CH3CH2OH) og methoxymethane (CH3OCH3). Denne forskjellen i konfigurasjonen av atomer i molekylene har en dramatisk effekt på volatiliteten i etanol versus methoxymethane.,
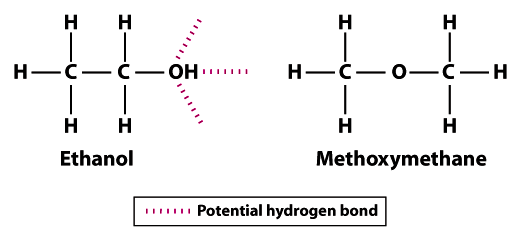 strukturer vise hvorfor etanol er mindre volatile enn methoxymethane; etanol kan danne tre hydrogen obligasjoner og methoxymethane kan ikke danne noen.Vær oppmerksom på at hydrogen atomer i methoxymethane kan ikke delta i hydrogenbinding med nabokommunene oksygen atomer. Hydrogen atom av hydroksyl gruppe (OH) i etanol øker potensialet for hydrogenbinding mellom nærliggende etanol molekyler. I forhold til methoxymethane, etanol er ikke på langt nær så flyktig. Kokepunktet for 78.5°C for etanol er betydelig høyere sammenlignet med -24.,8°C for methoxymethane. Dette eksemplet illustrerer betydningen av bond styrke generelt og hydrogenbinding spesielt som en faktor for gjennomsnittlig historisk volatilitet i et molekyl.
strukturer vise hvorfor etanol er mindre volatile enn methoxymethane; etanol kan danne tre hydrogen obligasjoner og methoxymethane kan ikke danne noen.Vær oppmerksom på at hydrogen atomer i methoxymethane kan ikke delta i hydrogenbinding med nabokommunene oksygen atomer. Hydrogen atom av hydroksyl gruppe (OH) i etanol øker potensialet for hydrogenbinding mellom nærliggende etanol molekyler. I forhold til methoxymethane, etanol er ikke på langt nær så flyktig. Kokepunktet for 78.5°C for etanol er betydelig høyere sammenlignet med -24.,8°C for methoxymethane. Dette eksemplet illustrerer betydningen av bond styrke generelt og hydrogenbinding spesielt som en faktor for gjennomsnittlig historisk volatilitet i et molekyl.
Legg igjen en kommentar