Et undernivå er en energi-nivået definert av kvanteteori.I kjemi, sublevels se energier forbundet med elektroner.I fysikk, sublevels kan også referere til energi assosiert med kjernen.,
Niels bohrs tidligste kvanteteori sa at elektroner okkupere sfærisk skall sentrert rundt atomkjernen, slik som de to elektron skjell vist for litium nedenfor:
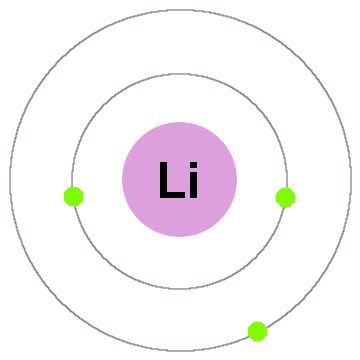
I denne gamle shell-modellen beveger seg utover:
- Shell 1 kan holde opp til 2 elektroner,
- Shell 2 kan holde opp til 8 elektroner,
- Shell 3 kan holde opp til 18 elektroner,
- Shell 4 kan holde opp til 32 elektroner,
- Shell 5 kan holde opp til 50 elektroner,…
Hver shell er faktisk en energi nivå., Jo høyere skall, jo høyere energi av sin elektron(er). Alle elektronene deling av et skall som er degenerert, noe som betyr at de har samme mengde energi.
Fremskritt i spektroskopi åpenbart at skjell kan faktisk inneholde subshells/sublevels.Elektroner i skall 3, for eksempel, kan ha ulike mengder energi fra hverandre fordi de opptar ulike sublevels.
energi nivå diagrammet nedenfor viser sublevels til så høyt som energi nivå av 5f orbitals.,Sublevels faktisk fortsette til høyere energier enn dette, men 5f er et passende sted å legge igjen en innledende beskrivelse.
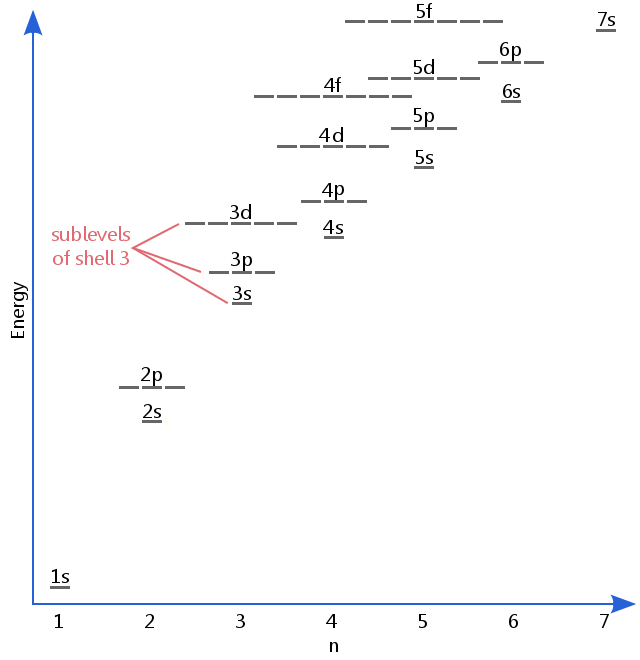

Electron sublevels er kjent med bokstavene s, p, d og f.Så, for eksempel, elektroner i s undernivå av shell-3 har en annen mengde energi fra elektroner i p-og d-nivåer av shell-3.(Dette er ikke tilfelle for hydrogen., Alle av hydrogen er sublevels har samme energi, fordi hydrogen har bare ett elektron.)
s, p, d, og f sublevels
undernivå okkupert av noen electron bestemmes av elektronets drivmoment quantum antall, l.,div id=»7de4153d3c»>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
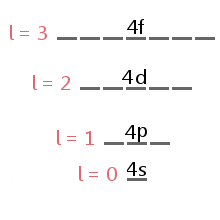
Undernivå orbitals har karakteristiske former som kan brukes til å forklare og forutsi kjemiske forbindelser som atomer kan danne.Disse figurene er basert på sannsynligheten for å finne et elektron i et bestemt plassering i bane rundt kjernen.
For eksempel, kan vi si at et elektron i et hydrogenatom er 1s undernivå vil bli funnet 99 prosent av tiden et sted i en sfære med en gitt radius rundt kjernen.Dette er grunnen til at vi kan trekke s undernivå er orbitals som en sfære.,
Orbitals for høyere sublevels er også trukket på grunnlag av hvor et atom er elektroner er mest sannsynlig å bli funnet. Se orbitals for mer informasjon.
En s undernivå er orbital
Undernivå Eksempler
Eksempler på sublevels finnes i ulike atomer er vist nedenfor. Den hevet skrift viser antall elektroner i hvert undernivå.
Hydrogen: 1s1
Karbon: 1s2 2s2 2p2
Klor: 1s2 2s2 2p6 3s2 3p5
Argon: 1s2 2s2 2p6 3s2 3p6
generelt, elektroner gå inn i den laveste tilgjengelige energi undernivå., Den generelle rekkefølgen sublevels er fylt er:
1s 2s 2p 3p 3s 4s 3d-4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d lagt 7 pence
Gitt dette, kan vi svare på spørsmål som: «hva er kalium er electron sublevels?»
Kalium har 19 elektroner, og vi vet at s orbitals holde maksimalt to elektroner, og p-maksimalt seks. Kalium er electron sublevels vil være:
Legg igjen en kommentar