Ikke lenge etter at G. N. Lewis popularisert elektron-dot-modell, kvantemekanikken ble en svært kraftig modell, med sin bruk for å beskrive den kjemiske bindingen. To modeller-den valence bond-modellen og molecular orbital modellen-ble utviklet nesten samtidig. Linus Pauling ble vinneren av valence bond-modellen, som er lettere å visualisere og bruke. Denne modellen er i hovedsak en kvantemekaniske versjon av elektron-dot-modell: den forsøker å beskrive hva orbitals brukes av hvert atom når elektronene er felles., For eksempel, når enkelt molekyl H2 er dannet fra hydrogen atomer, de valence bond-modellen sier at en s-orbital på ett atom overlapper med en s-orbital på den andre for å danne en obligasjon. Dette er ofte avbildet med en overlapping diagram og et bilde som vist i Figur 30.

Figur 30. Overlapping diagram og bilde for valence bond beskrivelse av diatomic hydrogen.,
En av de problemer som Pauling oppstått tidlig i sitt banebrytende arbeid med valence bond theory er tydelig eksemplifisert ved en enkel valence bond bilde av bonding i vann. Figur 31 viser to p-orbitals på oksygen overlappende med s-orbitals på hydrogens. Dette bildet viser tydelig at bond vinkel i vannet bør være 90°, fordi de to p-orbitals er justert langs x-og y-aksene og er derfor vinkelrett.

Figur 31. Orbital overlapp i vann.,
faktisk bond vinkel i vannet er 105°, en betydelig avgang fra 90°. Denne typen feil kan ikke synes viktige for deg, men hvis noen prøver å formulere en modell som vil forklare så mye av en bestemt del av naturen som mulig, er forskjellen mellom teori og eksperimentelt faktum er veldig plagsomt. Pauling, og deretter lagt en modifikasjon til teori-hybridisering., Pauling sa at atom-orbitals på et atom er ikke hellig, de er bare ett mulig sett av matematiske ligninger (husk vår diskusjon av bølge-modellen) som kan brukes til å beskrive elektroner i et atom. Andre sett kan genereres ved å legge til og trekke fra disse atomic orbitals i henhold til visse regler. Dermed, hvis en s-orbital og de tre p-orbitals er kombinert matematisk, et nytt sett av orbitals, sp3 orbitals, genereres. Den nye sett av orbitals har forskjellige orientational egenskaper enn angitt av atom-orbitals., Figur 32 viser s og tre p-orbitals i del (a) og deretter i del (b) fire nye sp3 hybrider. Som du kan se, disse sp3 hybrider er orientert mot hjørnene av en tetrahedrons. Figur 33 viser disse hybridene blir brukt til å beskrive bonding i vann. Fordi vinkelen mellom hybrider er 109°, forventer vi nå bond vinkel i vannet for å være 109°. Klart, dette gir oss bedre avtale med den eksperimentelle verdien av 105°. (Legg merke til at dette ikke er i perfekt avtalen, men det er det beste vi kan gjøre.,) Andre hybridisering kombinasjoner er også mulig, og disse er oppsummert i Figur 34.

Figur 32. sp3 hybridisering.
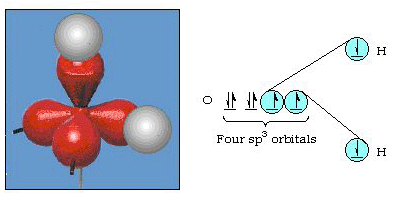
Figur 33. Bruk av sp3 hybrider for å forklare bond vinkel i vannet.
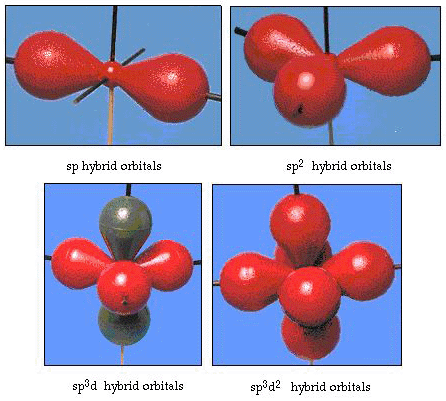
Figur 34. Andre hybridisering ordninger.
trykk for video –
– >
Det er en annen funksjon i valence bond modell som fortjener diskusjon. Det er fint illustrert av våre kjente molekyl oksygen, O2., Figur 35 viser overlapping av to px-orbitals å gi oss en enkelt obligasjon. Hvis vi skal adlyde octet-regelen, må vi også med å danne en annen bond. Dette må være av overlapping av to py eller to pz orbitals (det spiller ingen rolle hvilken). Denne bindingen har sin electron tetthet over og under internuclear linje, snarere enn direkte mellom de to oksygen kjerner. Denne bindingen er referert til som en 1-bond, mens en som setter electron tetthet mellom atomer kalles en sigma (σ) obligasjonslån., En av de interessante konsekvensene av dette bildet er at 1-bond er forventet å være svakere enn sigma-bond (overlappingen av orbitals er svakere). Dette betyr at en dobbeltbindingen ikke har den styrken av to enkle obligasjoner og er også mer utsatt for angrep fra eksterne atomer som leter etter et elektron tetthet.

Figur 35. Dannelsen av sigma og pi obligasjoner i diatomic oksygen.,
Som et siste eksempel på valence bond behandling av bonding, Figur 36 viser et bilde av orbitals involvert i bonding i ethene, den enkleste umettet hydrokarbon (H2C=CH2). Eksperimentelt, det har blitt vist at bond vinkler rundt hver karbon er nesten 120°. Dermed vår bildet viser bruken av sp2 hybrider (fordi de har 120° vinkler mellom hverandre) for bygging av sigma-bindinger. Den 1-bond er dannet av overlapping av to pz orbitals. Det er viktig å legge merke til at 1-bond introduserer en barriere for å rotasjon om karbon-karbon sammenhengen., Det er, hvis man CH2-gruppen var å rotere, 1-bond ville ha til å bli brutt, noe som vil kreve betydelig energi. Konsekvensen av dette er at 1-bond løser de to CH2-grupper i ett plan, slik at den samlede molekyl til å være plane.

Figur 36. Bonding i ethene.
The molecular orbital modellen tar en annen tilnærming. Det benytter alle orbitals på alle atomer for å generere et sett av orbitals som strekker seg over alle atomene på hele molekylet., Molecular orbital-modellen er mer vanskelig å se, men det er også kraftigere. Den vanskelige prosessen med å bestemme hvordan du vil kombinere atomic obitals for å generere molekylær orbitals er nå gjort av datamaskinen for selv store molekyler. Øvingen kjemiker bruker molecular orbital modell for å forutsi spektra, overgang stater, etc. men for hver dag kjemiske diskusjoner, elektron-prikk og valence bond modeller som fortsatt er regelen i dag.
Legg igjen en kommentar