de carbonylgroep
C = O is gevoelig voor toevoegingen en nucleofillische aanval vanwege de positieve lading van koolstof en de negatieve lading van zuurstof. De resonantie van de koolstof gedeeltelijke positieve lading staat de negatieve lading op het nucleofiel toe om de carbonylgroep aan te vallen en een deel van de structuur te worden en een positieve lading (gewoonlijk een proton waterstof) valt de zuurstof aan., Even ter herinnering, het nucleofiel is een goed zuur dus “houdt van protonen”, dus het zal de zijkant aanvallen met een positieve lading.
voordat we in detail de reactiviteit van aldehyden en ketonen bekijken, moeten we terugkijken en onszelf herinneren aan hoe het bindingsbeeld eruit ziet in een carbonyl. Carbonylcarbons zijn SP2 gehybridiseerd, waarbij de drie SP2 orbitalen soverlaps vormen met orbitalen op de zuurstof en op de twee koolstof-of waterstofatomen. Deze drie bindingen nemen trigonale vlakke meetkunde aan., De resterende ongehybride 2P orbitaal op de centrale carbonyl koolstof staat loodrecht op dit vlak, en vormt een ‘side-by-side’ pbond met een 2p orbitaal op de zuurstof.
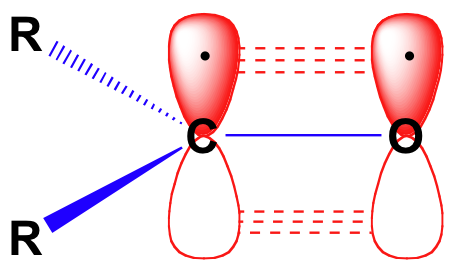
De dubbele koolstof-zuurstofbinding is polair: zuurstof is meer elektronegatief dan koolstof, dus de elektronendichtheid is hoger aan de zuurstofzijde van de binding en lager aan de koolstofzijde. Bedenk dat bondpolariteit kan worden afgebeeld met een dipoolpijl, of door de zuurstof te laten zien als een gedeeltelijke negatieve lading en de carbonylkoolstof een gedeeltelijke positieve lading.,

een derde manier om de koolstof-zuurstofdipool te illustreren is om de twee belangrijkste resonantie-bijdragers van een carbonylgroep te beschouwen: de belangrijkste vorm, die je meestal ziet getekend in Lewis-structuren, en een kleine maar zeer belangrijke bijdrager waarbij beide elektronen in de pbond gelokaliseerd zijn op de zuurstof, waardoor deze een volledige negatieve lading krijgt. De laatste afbeelding toont de koolstof met een lege 2P orbitaal en een volledige positieve lading.
Geef een reactie