een subniveau is een energieniveau gedefinieerd door kwantum theory.In chemie, subniveaus verwijzen naar energieën geassocieerd met electrons.In fysica, subniveaus kunnen ook verwijzen naar energieën geassocieerd met de kern.,
Niels Bohr ‘ s vroegste quantum theorie zei dat de elektronen bezetten sferische schelpen in het midden op de atoomkern, zoals de twee elektronenschillen weergegeven voor lithium hieronder:
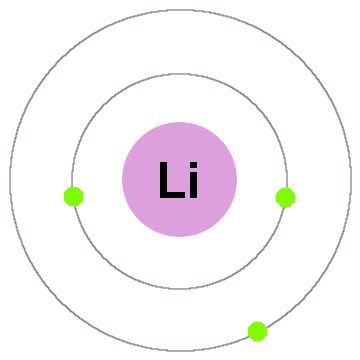
In deze oude shell-model verplaatsen naar buiten:
- Shell 1 kan maximaal 2 elektronen,
- Shell 2 kan maximaal 8 elektronen,
- Shell 3 kan maximaal 18 elektronen,
- Shell 4 kan maximaal 32 elektronen,
- Shell 5 kan maximaal 50 elektronen…
elke schil is eigenlijk een energieniveau., Hoe hoger de schil, hoe hoger de energie van zijn elektron(n). Alle elektronen die een schil delen zijn gedegenereerd, wat betekent dat ze dezelfde hoeveelheid energie hebben.
vooruitgang in de spectroscopie toonde aan dat schelpen daadwerkelijk subschellen / subniveaus kunnen bevatten.De elektronen in shell 3 bijvoorbeeld kunnen verschillende hoeveelheden energie van elkaar hebben omdat ze verschillende subniveaus innemen.
het energieniveaudiagram hieronder toont subniveaus die even hoog zijn als het energieniveau van de 5F-orbitalen.,Subniveaus gaan eigenlijk door naar hogere energieën dan deze, maar 5f is een geschikte plek om een inleidende beschrijving achter te laten.
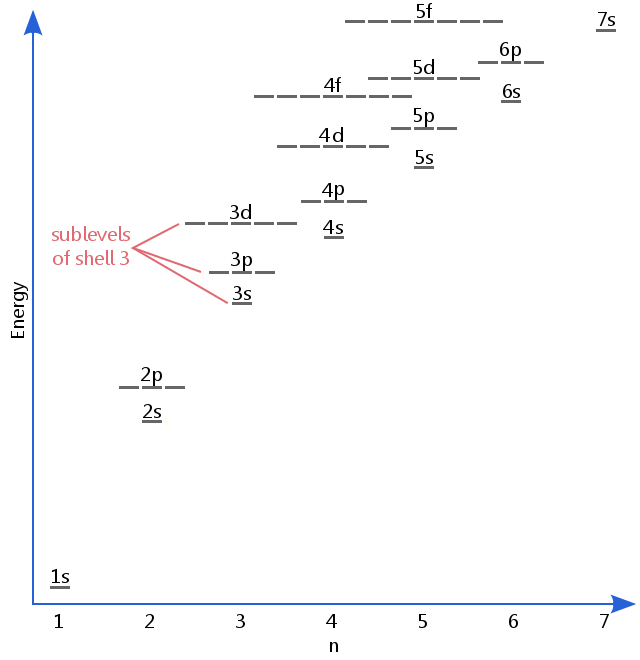

Electron subniveaus zijn bekend met de letters s, p, d, en f.Dus, bijvoorbeeld, de elektronen in de s-subniveau van shell 3 hebben een verschillende hoeveelheid energie van de elektronen in de p-en d-niveau van shell 3.(Dit is niet het geval voor waterstof., Alle subniveaus van waterstof hebben dezelfde energie, omdat waterstof maar één elektron heeft.)
S -, p -, d-en f-subniveaus
het subniveau dat door een elektron wordt ingenomen, wordt bepaald door het kwantumgetal van het impulsmoment van het elektron, l.,div id=”7de4153d3c”>
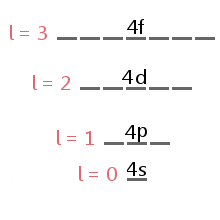
Geef een reactie