Achtergrond
insuline is een hormoon dat de hoeveelheid glucose (suiker) in het bloed reguleert en dat nodig is om het lichaam normaal te laten functioneren. Insuline wordt geproduceerd door cellen in de alvleesklier, de eilandjes van Langerhans genoemd. Deze cellen geven continu een kleine hoeveelheid insuline af in het lichaam, maar ze geven pieken van het hormoon af als reactie op een stijging van de bloedglucosespiegel.,
bepaalde cellen in het lichaam veranderen het voedsel dat wordt ingenomen in energie, of bloedglucose, die cellen kunnen gebruiken. Elke keer als iemand eet, stijgt de bloedglucose. Verhoogde bloedglucose activeert de cellen in de eilandjes van Langerhans om de benodigde hoeveelheid insuline vrij te geven. Met insuline kan de bloedglucose van het bloed naar de cellen worden getransporteerd. Cellen hebben een buitenwand, een membraan genaamd, die bepaalt wat de cel binnenkomt en verlaat. Onderzoekers weten nog niet precies hoe insuline werkt, maar ze weten wel dat insuline bindt aan receptoren op het membraan van de cel., Dit activeert een reeks transportmolecules zodat glucose en proteã nen de cel kunnen ingaan. De cellen kunnen dan de glucose als energie gebruiken om zijn functies uit te voeren. Eenmaal in de cel getransporteerd, wordt de bloedglucosespiegel binnen enkele uren weer normaal.
zonder insuline bouwt de bloedglucose zich op in het bloed en de cellen verhongeren van hun energiebron. Enkele van de symptomen die kunnen optreden omvatten vermoeidheid, constante infecties, wazig zicht, gevoelloosheid, tintelingen in de handen of benen, verhoogde dorst en vertraagde genezing van blauwe plekken of snijwonden., De cellen zullen beginnen om vet te gebruiken, de energiebron opgeslagen voor noodsituaties. Wanneer dit te lang gebeurt het lichaam produceert ketonen, chemicaliën geproduceerd door de lever. Ketonen kunnen cellen vergiftigen en doden als ze zich over een langere periode in het lichaam opbouwen. Dit kan leiden tot ernstige ziekte en coma.
mensen die niet de benodigde hoeveelheid insuline produceren, hebben diabetes. Er zijn twee algemene soorten diabetes. Het ernstigste type, bekend als type I of juveniele diabetes, is wanneer het lichaam geen insuline produceert., Type I diabetici injecteren zichzelf meestal drie tot vier keer per dag met verschillende soorten insuline. De dosering wordt genomen op basis van de bloedglucose lezing van de persoon, genomen van een glucosemeter. Type II diabetici produceren wat insuline, maar het is ofwel niet genoeg of hun cellen reageren niet normaal op insuline. Dit komt meestal voor bij zwaarlijvige of middelbare leeftijd en oudere mensen. Type II diabetici hoeven geen insuline te gebruiken, maar ze kunnen één-of twee keer per dag insuline injecteren.,
Er worden vier hoofdtypen insuline gefabriceerd op basis van hoe snel de insuline begint te werken, wanneer deze pieken vertoont en hoe lang deze in het lichaam aanhoudt. Volgens de American Diabetes Association, snelwerkende insuline bereikt het bloed binnen 15 minuten, pieken op 30-90 minuten, en kan duren vijf uur. Kortwerkende insuline bereikt het bloed binnen 30 minuten, pieken ongeveer twee tot vier uur later en blijft vier tot acht uur in het bloed., Middellangwerkende insuline bereikt het bloed twee tot zes uur na de injectie, pieken vier tot 14 uur later en kan 14-20 uur in het bloed blijven. En langwerkende insuline duurt zes tot 14 uur om te beginnen met werken, het heeft een kleine piek kort daarna en blijft 20-24 uur in het bloed. Diabetici hebben elk verschillende reacties op en behoeften aan insuline, dus er is geen enkel type dat het beste werkt voor iedereen. Sommige insuline wordt verkocht met twee van de soorten gemengd in één fles.,
anamnese
als het lichaam geen of voldoende insuline produceert, moeten mensen een gefabriceerde versie ervan nemen. Het belangrijkste gebruik van het produceren van insuline is voor diabetici die niet genoeg of een insuline natuurlijk maken. voordat onderzoekers ontdekten hoe insuline te produceren, hadden mensen met diabetes Type I geen kans op een gezond leven. Vervolgens in 1921, Canadese wetenschappers Frederick G. Banting en Charles H. best met succes gezuiverd insuline uit de alvleesklier van een hond. Door de jaren heen hebben wetenschappers voortdurend verbeteringen aangebracht in de productie van insuline., In 1936 vonden onderzoekers een manier om insuline te maken met een langzamere afgifte in het bloed. Ze voegden een eiwit in het sperma van vissen toe, protamine, dat het lichaam langzaam afbreekt. Eén injectie duurde 36 uur. Een andere doorbraak kwam in 1950 toen onderzoekers een type insuline produceerden dat iets sneller handelde en niet zo lang in de bloedbaan blijft. In de jaren zeventig begonnen onderzoekers te proberen en een insuline te produceren die meer nabootste hoe de natuurlijke insuline van het lichaam werkte: het vrijgeven van een kleine hoeveelheid insuline de hele dag met pieken die zich tijdens de maaltijden voordoen.,
onderzoekers bleven insuline verbeteren, maar de basisproductiemethode bleef decennialang hetzelfde. Insuline werd uit de alvleesklier van rundvee en varkens geëxtraheerd en gezuiverd. De chemische structuur van insuline bij deze dieren is slechts lichtjes anders dan humane insuline, dat is waarom het zo goed functioneert in het menselijk lichaam. (Hoewel sommige mensen een negatief immuunsysteem of allergische reacties hadden.) Toen in de vroege jaren 1980 biotechnologie een revolutie teweeggebracht insuline synthese. Onderzoekers hadden de chemische structuur van insuline al in het midden van de jaren 1950 gedecodeerd., Ze bepaalden al snel de exacte locatie van het insuline gen aan de top van chromosoom 11. Tegen 1977 had een onderzoeksteam een ratteninsulinegen gesplitst in een bacterie die vervolgens insuline produceerde.

, die begon in mei 1921, Banting en Best bond de alvleesklierkanalen af bij honden zodat de acinaire cellen zouden atrofiëren, en verwijderde vervolgens de pancreas om vocht uit eilandjecellen te halen. Ondertussen verwijderde ze pancreases van andere honden om diabetes te veroorzaken, injecteerde vervolgens de islet cel vloeistof. In januari 1922 werd de 14-jarige Leonard Thompson de eerste mens die succesvol behandeld werd voor diabetes met behulp van insuline. Best behaalde zijn medische graad in 1925., Banting stond erop dat Best ook zou worden gecrediteerd, en wees bijna zijn Nobelprijs af omdat Best niet was opgenomen. Best werd hoofd van de afdeling Fysiologie van de Universiteit van Toronto in 1929 en directeur van de universiteit Banting en beste afdeling van medisch onderzoek na Banting ‘ s dood in 1941.
in de jaren tachtig gebruikten onderzoekers genetische manipulatie om humane insuline te maken. In 1982 produceerde de Eli Lilly Corporation een humane insuline die het eerste goedgekeurde genetisch gemanipuleerde farmaceutische product werd., Zonder afhankelijk te zijn van dieren, konden onderzoekers genetisch gemanipuleerde insuline produceren in onbeperkte voorraden. Het bevatte ook geen van de dierlijke verontreinigingen. Het gebruik van humane insuline nam ook de bezorgdheid weg over het overzetten van mogelijke dierziekten in de insuline. Terwijl bedrijven vanaf de jaren tachtig nog steeds een kleine hoeveelheid insuline van dieren verkopen-voornamelijk varkens -, gingen insulinegebruikers steeds meer over op een vorm van humane insuline die door middel van recombinant-DNA-technologie werd gecreëerd., Volgens de Eli Lilly Corporation, in 2001 95% van de insulinegebruikers in de meeste delen van de wereld nemen een vorm van humane insuline. Sommige bedrijven zijn volledig gestopt met de productie van dierlijke insuline. Bedrijven richten zich op het synthetiseren van humane insuline en insuline-analogen, een modificatie van het insulinemolecuul op de een of andere manier.
grondstoffen
humane insuline wordt in het laboratorium gekweekt in veel voorkomende bacteriën. Escherichia coli is veruit het meest gebruikte type bacterie, maar gist wordt ook gebruikt.
onderzoekers hebben het humane eiwit nodig dat insuline produceert., Fabrikanten krijgen dit door middel van een aminozuur sequencing machine die het DNA synthetiseert. Fabrikanten kennen de exacte volgorde van de aminozuren van insuline (de moleculen op basis van stikstof die in de rij staan om eiwitten te maken). Er zijn 20 gemeenschappelijke aminozuren. De aminozuren van de fabrikanten input insuline, en de het rangschikken machine verbindt de aminozuren samen. Ook nodig om insuline te synthetiseren zijn grote tanks om de bacteriën te laten groeien, en voedingsstoffen zijn nodig voor de bacteriën om te groeien., Verscheidene instrumenten zijn noodzakelijk om DNA zoals een centrifuge, samen met diverse chromatografie en instrumenten van de röntgenkristallografie te scheiden en te zuiveren.
het productieproces
het synthetiseren van humane insuline is een biochemisch proces in meerdere stappen dat afhankelijk is van de basale recombinant-DNA-technieken en een goed begrip van het insulinegen. DNA draagt de instructies voor hoe het lichaam werkt en een klein segment van het DNA, het insulinegen, codeert voor de eiwitinsuline. Fabrikanten manipuleren de biologische voorloper van insuline zodat het in eenvoudige bacteriën groeit., Terwijl fabrikanten elk hun eigen variaties hebben, zijn er twee basismethoden om humane insuline te produceren.
werken met humane insuline
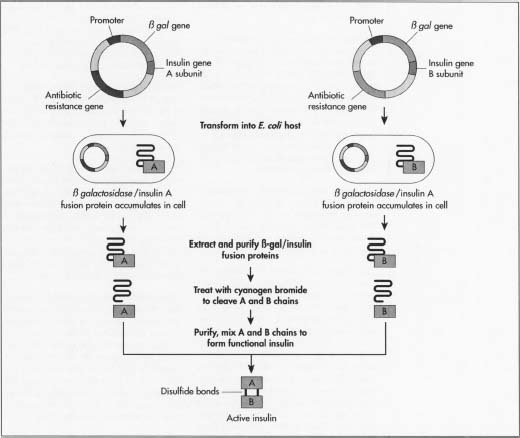
- 1 het insulinegen is een eiwit dat bestaat uit twee afzonderlijke ketens van aminozuren, een A boven een B-keten, die samen worden gehouden met bindingen. Aminozuren zijn de basiseenheden die alle eiwitten bouwen. De insuline a-keten bestaat uit 21 aminozuren en de B-keten heeft er 30.
- 2 voordat insuline een actief insuline-eiwit wordt, wordt het eerst aangemaakt als prepro-insuline., Dit is één enkele lange eiwitketen met de nog niet gescheiden A-en B-Kettingen, een sectie in het midden die de kettingen samen en een signaalopeenvolging aan één eind het vertellen van de proteã ne wanneer te beginnen het afscheiden buiten de cel. Na prepro-insuline, evolueert de keten in pro-insuline, nog steeds een enkele keten, maar zonder de signalerende sequentie. Dan komt het actieve eiwit insuline, het eiwit zonder de sectie die de A en B ketens verbindt. Bij elke stap heeft het eiwit specifieke enzymen nodig (eiwitten die chemische reacties uitvoeren) om de volgende vorm van insuline te produceren.,
beginnend met A en B
- 3 Eén methode voor de productie van insuline is om de twee insulineketens afzonderlijk te laten groeien. Dit zal voorkomen dat de productie van elk van de specifieke enzymen nodig. Fabrikanten hebben de twee mini-genen nodig: één die de A-keten produceert en één voor de B-keten. Aangezien de exacte opeenvolging van DNA van elke keten bekend is, synthetiseren zij het DNA van elk mini-gen in een aminozuur het rangschikken machine.
- 4 Deze twee DNA-moleculen worden vervolgens ingebracht in plasmiden, kleine cirkelvormige stukjes DNA die gemakkelijker door het DNA van de gastheer worden opgenomen.,
- 5 fabrikanten brengen de plasmiden eerst in een niet-schadelijk type van de bacterie E. coli. Ze plaatsen het naast het lacZ-gen. LacZ codeert voor 8-galactosidase, een gen dat veel wordt gebruikt in recombinant-DNA-procedures omdat het gemakkelijk te vinden en te snijden is, waardoor de insuline gemakkelijk kan worden verwijderd, zodat het niet verloren gaat in het DNA van de bacterie. Naast dit gen bevindt zich het aminozuur methionine, dat de eiwitvorming start.
- 6 de recombinante, nieuw gevormde plasmiden worden gemengd met de bacteriële cellen. Plasmiden gaan de bacteriën in een proces genaamd transfectie., De fabrikanten kunnen aan de cellen DNA-ligase toevoegen, een enzym dat als lijm werkt om het plasmide aan het DNA van de bacterie te helpen plakken.
- 7 de bacteriën die de insuline synthetiseren ondergaan vervolgens een fermentatieproces. Ze worden geteeld bij optimale temperaturen in grote tanks in fabrieken. De miljoenen bacteriën repliceren zich ongeveer elke 20 minuten via cel mitose, en elk drukt het insulinegen uit.
- 8 na vermenigvuldiging worden de cellen uit de tanks gehaald en opengebroken om het DNA te extraheren., Één gemeenschappelijke manier dit wordt gedaan is door eerst een mengsel van lysozome toe te voegen dat de buitenlaag van de celwand verteert, dan het toevoegen van een detergentmengsel dat het vette membraan van de celwand scheidt. Het DNA van de bacterie wordt vervolgens behandeld met cyanogenbromide, een reagens dat de eiwitketens van de methionineresiduen splitst. Dit scheidt de insulineketens van de rest van het DNA.
- 9 de twee ketens worden vervolgens gemengd en met elkaar verbonden door disulfidebindingen via de reductie-reoxidatiereactie. Een oxiderende agent (een materiaal dat oxidatie of de overdracht van een elektron veroorzaakt) wordt toegevoegd., De batch wordt vervolgens in een centrifuge geplaatst, een mechanisch apparaat dat snel draait om celcomponenten op grootte en dichtheid te scheiden.
- 10 het DNA-mengsel wordt vervolgens gezuiverd zodat alleen de insulineketens overblijven. De fabrikanten kunnen het mengsel door verscheidene chromatografie, of scheiding, technieken zuiveren die verschillen in de last van de molecule, grootte, en affiniteit aan water exploiteren. De gebruikte Procedures omvatten een ion-exchange kolom, omgekeerde-fase hoge prestaties vloeibare chromatografie, en een kolom van de de chromatografie van de gelfiltratie., Fabrikanten kunnen insulinebatches testen om er zeker van te zijn dat geen van de E. coli-eiwitten van de bacterie met de insuline wordt gemengd. Ze gebruiken een marker-eiwit waarmee ze E. coli-DNA kunnen detecteren. Zij kunnen dan bepalen dat het zuiveringsproces de E. coli bacteriën verwijdert.
Pro-INSULINEPROCES
- 11 vanaf 1986 begonnen fabrikanten een andere methode te gebruiken om humane insuline te synthetiseren. Ze begonnen met de directe voorloper van het insuline gen, pro-insuline., Veel van de stappen zijn hetzelfde als wanneer het produceren van insuline met de kettingen A en B, behalve in deze methode de aminozuurmachine het pro-insulinegen samenstelt.
- 12 de sequentie die voor pro-insuline codeert, wordt ingevoegd in de niet-pathogene E. coli-bacteriën. De bacteriën gaan door het fermentatieproces waar ze zich voortplanten en pro-insuline produceren. Dan wordt de verbindende opeenvolging tussen de kettingen A en B met een enzym verbonden en wordt de resulterende insuline gezuiverd.,
- 13 aan het einde van het productieproces worden ingrediënten toegevoegd aan insuline om bacteriën te voorkomen en een neutraal evenwicht tussen zuren en basen te behouden. Ingrediënten worden ook toegevoegd aan middellang-en langwerkende insuline om de gewenste duur van het type insuline te produceren. Dit is de traditionele methode om langer werkende insuline te produceren. Fabrikanten voegen ingrediënten toe aan de gezuiverde insuline die hun werking verlengen, zoals zinkoxide. Deze additieven vertragen de opname in het lichaam. Additieven variëren tussen verschillende merken van hetzelfde type insuline.,
analoge insuline
midden jaren negentig begonnen onderzoekers de werking van humane insuline in het lichaam te verbeteren door de aminozuurvolgorde te veranderen en een analoog te creëren, een chemische stof die een andere stof goed genoeg nabootst om de cel voor de gek te houden. Analoge insuline klontert minder en verspreidt zich gemakkelijker in het bloed, waardoor de insuline om te beginnen met werken in het lichaam minuten na een injectie. Er zijn verschillende analoge insuline. Humulin insuline heeft geen sterke bindingen met andere insuline en wordt dus snel geabsorbeerd., Een andere insuline-analoog, genaamd Glargine, verandert de chemische structuur van het eiwit om het een relatief constante afgifte te maken over 24 uur zonder uitgesproken pieken.
in plaats van de exacte DNA-sequentie voor insuline te synthetiseren, synthetiseren fabrikanten een insulinegen waarbij de sequentie enigszins veranderd is. De verandering veroorzaakt het resulterende
eiwitten om elkaar af te stoten, wat minder klonteren veroorzaakt., Gebruikend deze veranderde opeenvolging van DNA, is het productieproces gelijkaardig aan het beschreven recombinant DNA-proces.
kwaliteitscontrole
na de synthese van de humane insuline worden de structuur en de zuiverheid van de insulinebatches aan de hand van verschillende methoden getest. De hoge prestatiesvloeistofchromatografie wordt gebruikt om te bepalen of er om het even welke onzuiverheden in de insuline zijn. Andere scheidingstechnieken, zoals kristallografie van de Röntgenstraal, gelfiltratie, en aminozuur het rangschikken, worden ook uitgevoerd. Fabrikanten testen ook de verpakking van de flacon om er zeker van te zijn dat deze goed is verzegeld.,
productie voor humane insuline moet voldoen aan de procedures van het National Institutes of Health voor grootschalige operaties. De Amerikaanse Food and Drug Administration moet alle geproduceerde insuline goedkeuren.
de toekomst
de toekomst van insuline heeft vele mogelijkheden. Aangezien insuline voor het eerst werd gesynthetiseerd, moesten diabetici regelmatig de vloeibare insuline met een spuit rechtstreeks in hun bloedbaan injecteren. Hierdoor kan de insuline direct in het bloed terechtkomen. Jarenlang was het de enige manier om het intacte insuline-eiwit in het lichaam te brengen., In de jaren 1990, onderzoekers begonnen inroads te maken in het synthetiseren van verschillende apparaten en vormen van insuline die diabetici kunnen gebruiken in een alternatieve drug levering systeem.
fabrikanten produceren momenteel een aantal relatief nieuwe geneesmiddelenafgifteapparaten. Insulinepennen zien eruit als een schrijfpen. Een patroon bevat de insuline en de punt is de naald. De gebruiker stelt een dosis in, brengt de naald in de huid en drukt op een knop om de insuline te injecteren. Met pennen het is niet nodig een injectieflacon met insuline te gebruiken. De pennen moeten echter voor elke injectie afzonderlijke punten inbrengen., Een ander nadeel is dat de pen niet toestaat dat gebruikers insuline typen mengen en dat niet alle insuline beschikbaar is.
voor mensen die een hekel hebben aan naalden is een alternatief voor de pen de jet-injector. Gelijkend op de pennen, gebruiken straalinjectors druk om een kleine stroom insuline door de huid te stuwen. Deze apparaten worden niet zo veel gebruikt als de pen, en ze kunnen kneuzingen veroorzaken op het invoerpunt.
de insulinepomp zorgt voor een gecontroleerde afgifte in het lichaam. Dit is een computergestuurde pomp, zo groot als een pieper, die diabetici aan hun riem of in hun zak kunnen dragen., De pomp heeft een kleine flexibele buis die net onder het oppervlak van de diabetische huid wordt ingebracht. De diabeticus stelt de pomp in om een constante, afgemeten dosis insuline gedurende de dag af te leveren, waardoor de hoeveelheid vlak voor het eten wordt verhoogd. Dit bootst de normale afgifte van insuline in het lichaam na. Fabrikanten hebben insulinepompen geproduceerd sinds de jaren 1980, maar de vooruitgang in de late jaren 1990 en het begin van de eenentwintigste eeuw hebben ze steeds gemakkelijker te gebruiken en populairder gemaakt. Onderzoekers onderzoeken de mogelijkheid van implanteerbare insulinepompen., Diabetici zouden deze apparaten besturen via een externe afstandsbediening.
onderzoekers onderzoeken andere opties voor de toediening van geneesmiddelen. Het innemen van insuline via pillen is een mogelijkheid. De uitdaging met eetbare insuline is dat de maag hoog zure omgeving vernietigt het eiwit voordat het kan bewegen in het bloed. Onderzoekers werken aan het coaten van insuline met plastic ter breedte van een paar menselijke haren. De bekleding beschermt de medicijnen tegen maagzuur.,
in 2001 vinden veelbelovende tests plaats op insuline voor inhalatie en de fabrikanten zouden binnen enkele jaren met de productie van de producten kunnen beginnen. Omdat insuline een relatief groot eiwit is, dringt het niet door in de longen. Onderzoekers van insuline voor inhalatie werken aan insulinedeeltjes die klein genoeg zijn om de diepe Long te bereiken. De deeltjes kunnen dan overgaan in de bloedbaan. De onderzoekers testen verscheidene inhalatieapparaten veel zoals die van een astma-inhalator.
een andere vorm van aerosol die een test ondergaat, zal insuline toedienen op de binnenwang., Diabetici, bekend als buccale (Wang) insuline, spuiten de insuline op de binnenkant van hun wang. Het wordt dan geabsorbeerd door de binnenwangwand.
Insulinepleisters zijn een ander geneesmiddelafgiftesysteem in ontwikkeling. Pleisters zouden insuline continu vrijgeven in de bloedbaan. De gebruikers zouden een lipje op de pleister trekken om meer insuline vóór de maaltijd vrij te geven. De uitdaging is het vinden van een manier om insuline door de huid te laten passeren. Echografie is een methode die onderzoekers onderzoeken. Deze geluidsgolven met lage frequentie kunnen de doorlaatbaarheid van de huid veranderen en insuline laten passeren.,
ander onderzoek kan ertoe leiden dat fabrikanten niet langer insuline hoeven te synthetiseren. De onderzoekers werken aan het creëren van de cellen die insuline in het laboratorium produceren. De gedachte is dat artsen op een dag de niet-werkende alvleeskliercellen kunnen vervangen door insuline-producerende cellen. Een andere hoop voor diabetici is gentherapie. Wetenschappers werken aan het corrigeren van de mutatie van het insulinegen zodat diabetici zelf insuline kunnen produceren.
M. Rae Nelson
Geef een reactie