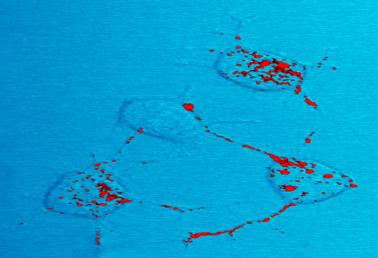
Prionproteïne, getoond in rood, kan infectieus worden en neurodegeneratieve ziekte veroorzaken. Hier illustreren vier zenuwcellen in een muis hoe infectieus prioneiwit zich beweegt binnen cellen langs neurieten-draad-achtige verbindingen die de zenuwcellen gebruiken voor de communicatie met aangrenzende cellen.,
Prioneiwit, dat in rood wordt getoond, kan infectieus worden en neurodegeneratieve ziekte veroorzaken. Hier illustreren vier zenuwcellen in een muis hoe infectieus prioneiwit zich beweegt binnen cellen langs neurieten-draad-achtige verbindingen die de zenuwcellen gebruiken voor de communicatie met aangrenzende cellen.
prionziekten, ook bekend als overdraagbare spongiforme encefalopathieën of TSE ‘ s, zijn een groep zeldzame, fatale hersenziekten die dieren en mensen treffen., Ze worden veroorzaakt door een infectieus agens dat bekend staat als prion, dat is afgeleid van een misfolded versie van een normaal gastheerproteïne dat bekend staat als prionproteïne. Prionziekten omvatten boviene spongiforme encefalopathie (BSE of “gekkekoeienziekte”) bij runderen, de ziekte van Creutzfeldt-Jakob (CJD) en variant CJD bij mensen, scrapie bij schapen en chronic wasting disease (CWD) bij herten, elanden, elanden en rendieren.
Waarom is het onderzoek naar prionziekten een prioriteit voor NIAID?,
prionziekten vormen een belangrijk probleem voor de volksgezondheid en het is bekend dat ze zich via bloed van dieren op mensen en, in het geval van de variant van de ziekte van Creutzfeldt-Jakob, van mens op mens verspreiden. Prionziekten bij mensen zijn moeilijk te diagnosticeren en wanneer ze worden gediagnosticeerd, zijn er geen effectieve behandelingen beschikbaar. Als gevolg daarvan zijn ze onvermijdelijk fataal. Veel over prionziekten blijft echter onbekend en inzicht in de werking ervan is belangrijk voor de ontwikkeling van zowel diagnostische tests als effectieve therapieën., Prionziekten zijn ook gerelateerd aan andere eiwit misfolding ziekten zoals de ziekte van Alzheimer, de ziekte van Parkinson, en Lewy lichaam dementie. Prionziekten zijn ook gerelateerd aan ziekten waarbij het tau-eiwit verkeerd vouwt, waaronder chronische traumatische encefalopathie (CTE), die wordt geassocieerd met hersenbeschadiging door herhaalde hoofdletsel. Zo kan onderzoek naar prionziekten wetenschappers ook helpen om andere verwante ziekten beter te begrijpen.
Hoe behandelt NIAID dit kritische onderwerp?,
NIAID wetenschappers onderzoeken hoe prionziekten zich ontwikkelen en zich tussen mens en dier verspreiden, hoe ze gediagnosticeerd kunnen worden en hoe ze behandeld kunnen worden. NIAID voert prion ziekte onderzoek in de Rocky Mountain laboratoria in Hamilton, Montana, en financiert ook prion ziekte onderzoek in universitaire laboratoria. NIAID-samenwerking met andere NIH-groepen die verouderingsstoornissen en neurologische ziekten bestuderen, is ook belangrijk., Twee andere instituten van de National Institutes of Health financieren ook prion ziekteonderzoek – het National Institute of Neurological Disorders and Stroke en het National Institute on Aging.
om meer te weten te komen over risicofactoren voor prionziekten en de huidige preventie-en behandelingsstrategieën, bezoek de prionziektes site van het Centers for Diseases Control and Prevention (CDC).,op de Test voor de Zeldzame Ziekten van de Hersenen
16 oktober 2019
2 augustus 2019
NIAID Nu Blog
-
Dag van de Zeldzame Ziekten 2019—NIAID Middelen en Onderzoek Hoogtepunten
22 februari 2019
Biologie & Genetica
Prion aandoeningen die worden geassocieerd met het prion-eiwit, dat voorkomt in vele verschillende weefsels, waaronder de hersenen., Normaal gesproken veroorzaakt prioneiwit geen ziekte en bevindt het zich op het oppervlak van vele celtypen. Hoewel onder onderzoek, wetenschappers denken dat normale prion-eiwit kan helpen de hersenen te beschermen tegen schade. Ze weten wel dat wanneer veel normale prionproteïnemoleculen van vorm veranderen en samenklonteren, ze zich kunnen aggregeren in hersenweefsel en de infectieuze prionen kunnen vormen die prionziekte veroorzaken. Prionziekten worden daarom veroorzaakt door een infectieus, abnormaal gevormd en geaggregeerd prioneiwit. Wetenschappers weten niet zeker waarom normaal prion-eiwit misvormd wordt., NIAID wetenschappers Co-ontdekt het prion-eiwit gen en waren een van de eersten om aan te tonen dat abnormale prion-eiwit normale prion-eiwit kan veranderen in de abnormale, infectieuze vorm.
Lees meer over prionziekten biologie en genetica
therapeutische benaderingen
hoewel er geen bekende manieren zijn om prionziekten te genezen, werken wetenschappers over de hele wereld aan de ontwikkeling van behandelingen en diagnostiek. NIAID-onderzoekers hebben een snelle diagnostische test voor prionziekten ontwikkeld., Met behulp van reageerbuis of cel-gebaseerde modellen van prion infectie voor snelle eerste screening, NIAID onderzoekers hebben ook duizenden verbindingen getest en geïdentificeerd honderden moleculen die de vorming van de abnormale, infectieuze vorm van prion-eiwit remmen. Verder testen van de meest krachtige van deze remmers heeft aangetoond dat een aantal die het leven van knaagdieren kan verlengen, zelfs als de behandeling begint na infectie.,
Lees meer over therapeutische benaderingen voor prionziekten
dierziekten en mensen
Er zijn 3 belangrijke prionziekten bij dieren: scrapie bij schapen, boviene spongiforme encefalopathie (BSE) bij runderen en chronic wasting disease (CWD) bij herten, elanden en andere hertachtigen. NIAID-wetenschappers gebruiken verschillende experimentele modellen om te bestuderen hoe prionen van één diersoort verschillende diersoorten kunnen infecteren. Deze omvatten studies om te bepalen of dierziekten zoals CWD mensen kunnen infecteren en de ziekte van Creutzfeldt-Jakob (CJD) kunnen veroorzaken.,
Lees meer over prionziekten bij dieren en mensen
Geef een reactie