Methoxymethaan heeft dezelfde moleculaire formule, hetzelfde aantal elektronen en ongeveer dezelfde vorm en grootte als ethanol. Ondanks deze overeenkomsten verschillen de structuurformules (de organisatie van de individuele moleculen in de ruimte) tussen ethanol (CH3CH2OH) en methoxymethaan (CH3OCH3). Dit verschil in de configuratie van de atomen binnen de molecules heeft een dramatisch effect op de vluchtigheid van ethylalcohol versus methoxymethaan.,
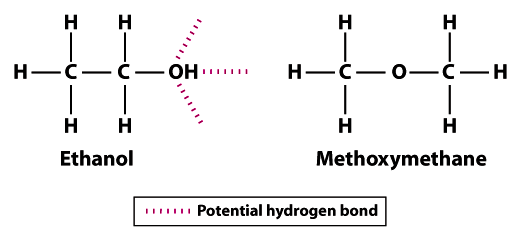 de structuren laten zien waarom ethanol minder vluchtig is dan methoxymethaan; ethanol kan drie waterstofbindingen vormen en methoxymethaan niet.Merk op dat de waterstofatomen in methoxymethaan niet kunnen deelnemen aan waterstofbinding met naburige zuurstofatomen. Het waterstofatoom van de hydroxylgroep (OH) in ethanol verhoogt het potentieel voor waterstofbindingen tussen naburige ethanolmoleculen. Vergeleken met methoxymethaan is ethanol lang niet zo vluchtig. Het kookpunt van 78,5°C voor ethanol is beduidend hoger in vergelijking met -24.,8°C voor methoxymethaan. Dit voorbeeld illustreert de Betekenis van bindingssterkte in het algemeen en waterstofbindingen specifiek als determinant van vluchtigheid van een molecuul.
de structuren laten zien waarom ethanol minder vluchtig is dan methoxymethaan; ethanol kan drie waterstofbindingen vormen en methoxymethaan niet.Merk op dat de waterstofatomen in methoxymethaan niet kunnen deelnemen aan waterstofbinding met naburige zuurstofatomen. Het waterstofatoom van de hydroxylgroep (OH) in ethanol verhoogt het potentieel voor waterstofbindingen tussen naburige ethanolmoleculen. Vergeleken met methoxymethaan is ethanol lang niet zo vluchtig. Het kookpunt van 78,5°C voor ethanol is beduidend hoger in vergelijking met -24.,8°C voor methoxymethaan. Dit voorbeeld illustreert de Betekenis van bindingssterkte in het algemeen en waterstofbindingen specifiek als determinant van vluchtigheid van een molecuul.
Geef een reactie