niet lang nadat G. N. Lewis het elektron-dot model populariseerde, werd de kwantummechanica een zeer krachtig model, inclusief het gebruik ervan om de chemische binding te beschrijven. Twee modellen — het valentiebindingsmodel en het moleculaire orbitale model — werden bijna gelijktijdig ontwikkeld. Linus Pauling werd de kampioen van het valence bond-model, dat gemakkelijker te visualiseren en te gebruiken is. Dit model is in wezen een kwantummechanische versie van het elektron-dot model: het probeert te beschrijven welke orbitalen door elk atoom worden gebruikt wanneer elektronen worden gedeeld., Bijvoorbeeld, wanneer het eenvoudige molecuul H2 wordt gevormd uit waterstofatomen, zegt het valentiebindingsmodel dat een s-orbitaal op het ene atoom overlapt met een s-orbitaal op het andere om een binding te vormen. Dit wordt soms afgebeeld door een overlappingsdiagram en een afbeelding zoals afgebeeld in figuur 30.

figuur 30. Overlapdiagram en afbeelding voor de valentiebindingsbeschrijving van diatomaire waterstof.,een van de problemen die Pauling al vroeg in zijn pionierswerk met de valentiebindingstheorie tegenkwam, wordt duidelijk geïllustreerd door een eenvoudig valentiebindingsbeeld van de binding in water. Figuur 31 toont twee p-orbitalen op zuurstof die overlappen met s-orbitalen op waterstof. Deze foto laat duidelijk zien dat de bindingshoek in water 90° moet zijn, omdat de twee p-orbitalen langs de x-en y-as uitgelijnd zijn en dus loodrecht staan.

figuur 31. Orbitale overlap in water.,
in feite is de bindingshoek in water 105°, een significante afwijking van 90°. Dit soort fouten lijkt misschien niet belangrijk voor jou, maar voor iemand die probeert een model te formuleren dat zoveel mogelijk van een bepaald deel van de natuur zal verklaren, is dit verschil tussen theorie en experimenteel feit erg hinderlijk. Pauling voegde toen nog een wijziging toe aan de theorie–hybridisatie., Pauling zei dat atomaire orbitalen op een atoom niet onaantastbaar zijn, ze zijn slechts een mogelijke verzameling wiskundige vergelijkingen (denk aan onze bespreking van het golfmodel) die kunnen worden gebruikt om de elektronen in dat atoom te beschrijven. Andere Verzamelingen kunnen worden gegenereerd door het optellen en aftrekken van deze atomaire orbitalen volgens bepaalde regels. Dus, als een s orbitaal en de drie p-orbitalen wiskundig worden gecombineerd, wordt een nieuwe verzameling orbitalen, sp3 orbitalen, gegenereerd. De nieuwe verzameling orbitalen heeft andere oriëntatiekenmerken dan de verzameling atomaire orbitalen., Figuur 32 toont de s en drie p-orbitalen in deel (a) en vervolgens in Deel (b) De vier nieuwe SP3 hybriden. Zoals je kunt zien, zijn deze SP3 hybriden gericht op de hoeken van een tetraëder. Figuur 33 laat zien dat deze hybriden worden gebruikt om de binding in water te beschrijven. Omdat de hoek tussen de hybriden 109° is, verwachten we nu dat de bindingshoek in water 109°is. Dit geeft ons duidelijk een betere overeenkomst met de experimentele waarde van 105°. (Merk op dat dit niet in perfecte overeenstemming is, maar het is het beste wat we kunnen doen.,) Andere combinaties van hybridisatie zijn ook mogelijk, en deze zijn samengevat in Figuur 34.

figuur 32. SP3 hybridisatie.
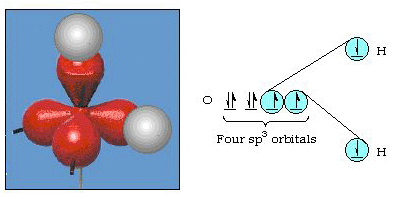
figuur 33. Gebruik van SP3 hybriden om de bindingshoek in water te verklaren.
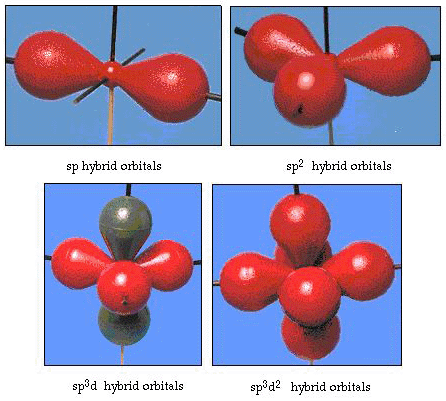
figuur 34. Andere hybridisatieschema ‘ s.
druk op video
Er is nog een ander kenmerk van het Valence bond-model dat discussie verdient. Het wordt mooi geïllustreerd door ons bekende zuurstofmolecuul, O2., Figuur 35 toont de overlapping van twee px-orbitalen om ons een enkele binding te geven. Als we de octet regel moeten gehoorzamen, moeten we ook een andere band vormen. Dit moet door overlap van twee py of twee PZ orbitalen (het maakt niet uit welke). Deze binding heeft zijn elektronendichtheid boven en onder de internucleaire Lijn, in plaats van direct tussen de twee zuurstofkernen. Deze binding wordt aangeduid als een 1-binding, terwijl degene die elektronendichtheid tussen de atomen plaatst een Sigma (σ) binding wordt genoemd., Een van de interessante gevolgen van dit beeld is dat de 1-binding naar verwachting zwakker is dan de sigma-binding (de overlap van de orbitalen is zwakker). Dit betekent dat een dubbele binding niet de sterkte van twee enkele bindingen heeft en ook vatbaarder is voor aanvallen door externe atomen die op zoek zijn naar elektronendichtheid.

figuur 35. Vorming van Sigma-en pi-bindingen in diatomaire zuurstof.,
als laatste voorbeeld van de valentiebinding behandeling van binding, figuur 36 toont een beeld van de orbitalen betrokken bij de binding in etheen, de eenvoudigste onverzadigde koolwaterstof (H2C=CH2). Experimenteel is aangetoond dat de bindingshoeken rond elke koolstof bijna 120°zijn. Zo toont onze foto het gebruik van SP2 hybriden (omdat ze 120° hoeken tussen elkaar hebben) voor de constructie van de sigma bindingen. De 1-binding wordt gevormd door overlapping van twee PZ orbitalen. Het is belangrijk op te merken dat de 1-binding een rotatiebarrière introduceert rond de koolstof-koolstofverbinding., Dat wil zeggen, als één CH2 groep zou draaien, zou de 1-binding verbroken moeten worden, wat veel energie zou vergen. Het gevolg hiervan is dat de 1-binding de twee CH2-groepen in één vlak fixeert, waardoor het totale molecuul vlak is.

figuur 36. De binding in etheen.
het moleculaire orbitale model hanteert een andere benadering. Het gebruikt alle orbitalen op alle atomen om een reeks orbitalen te genereren die zich uitstrekken over alle atomen op het hele molecuul., Het moleculaire orbitale model is moeilijker te visualiseren, maar het is ook krachtiger. Het moeilijke proces om te bepalen hoe atomaire obitaliën te combineren om moleculaire orbitalen te genereren wordt nu gedaan door de computer voor zelfs grote moleculen. De praktiserende chemicus gebruikt het moleculaire orbitale model om spectra, transitietoestanden, enz. te voorspellen., maar voor alledaagse chemische discussies, de elektron-dot en valentie bond modellen nog steeds de regel van de dag.
Geef een reactie