Grupa Karbonylowa
C=O jest podatna na dodatki i atak nukleofilowy, ponieważ ładunek dodatni węgla i ładunek ujemny tlenu. Rezonans częściowego ładunku dodatniego węgla pozwala, aby ładunek ujemny na nukleofilu atakował grupę karbonylową i stał się częścią struktury, a ładunek dodatni (Zwykle Proton wodorowy) atakował tlen., Dla przypomnienia, nukleofil jest dobrym kwasem, dlatego „lubi protony”, więc zaatakuje stronę ładunkiem dodatnim.
zanim szczegółowo rozważymy reaktywność aldehydów i ketonów, musimy spojrzeć wstecz i przypomnieć sobie, jak wygląda obraz wiązania w karbonylu. Węglany karbonylowe są hybrydyzowane sp2, z trzema orbitalami sp2 tworzącymi soverlapy z orbitalami na tlen i na dwa atomy węgla lub wodoru. Te trzy wiązania przyjmują trygonalną geometrię płaską., Pozostały niehybryzowany orbital 2p na centralnym karbonylu jest prostopadły do tej płaszczyzny i tworzy „obok siebie” Orbital 2P na tlen.
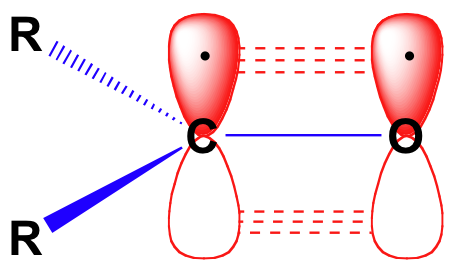
podwójne wiązanie węgiel-tlen jest polarne: tlen jest bardziej elektronowy niż węgiel, więc gęstość elektronów jest wyższa po stronie tlenu i niższa po stronie węgla. Przypomnijmy, że polaryzacja wiązania może być przedstawiona za pomocą strzałki dipolowej lub pokazując tlen jako posiadający częściowy ładunek ujemny, a węgiel karbonylowy częściowy ładunek dodatni.,

trzecim sposobem zilustrowania dipola węglowo-tlenowego jest rozważenie dwóch głównych czynników wpływających na rezonans grupy karbonylowej: głównej formy, która jest zazwyczaj widoczna w strukturach Lewisa, oraz niewielkiego, ale bardzo ważnego czynnika, w którym oba elektrony w pbond są zlokalizowane na tlen, dając mu pełny ładunek ujemny. Ten ostatni obraz pokazuje węgiel z pustym orbitalem 2p i pełnym ładunkiem dodatnim.
Dodaj komentarz