podpoziom jest poziomem energetycznym zdefiniowanym przez kwant theory.In chemii, podpoziomy odnoszą się do energii związanych z electrons.In fizyka, podpoziomy mogą również odnosić się do energii związanych z jądrem.,
Najwcześniejsza teoria kwantowa Nielsa Bohra mówi, że elektrony zajmują sferyczne powłoki skupione na jądrze atomowym, takie jak dwie powłoki elektronowe pokazane poniżej dla litu:
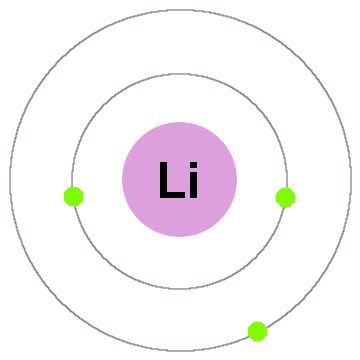
w tym starym modelu powłoki poruszającej się na zewnątrz:
- powłoka 1 może pomieścić do 2 elektronów,
- powłoka 2 może pomieścić do 8 elektronów,
- powłoka 3 może pomieścić do 18 elektronów,
- powłoka 4 może pomieścić do 32 elektronów,
- powłoka 5 może pomieścić do 50 elektronów,…
,
każda powłoka jest w rzeczywistości poziomem energetycznym., Im wyższa powłoka, tym większa energia jej elektronów. Wszystkie elektrony dzielące powłokę są zdegenerowane, co oznacza, że mają taką samą ilość energii.
postępy w spektroskopii ujawniły, że muszle mogą faktycznie zawierać podszafki / podpoziomy.Elektrony w powłoce 3, na przykład, mogą mieć różne ilości energii od siebie, ponieważ zajmują różne podpoziomy.
poniższy diagram poziomu energii pokazuje podpoziomy tak wysokie, jak poziom energii orbitali 5f.,Sublevels faktycznie nadal wyższe Energie niż to, ale 5f jest odpowiednim miejscem, aby zostawić wstępny opis.
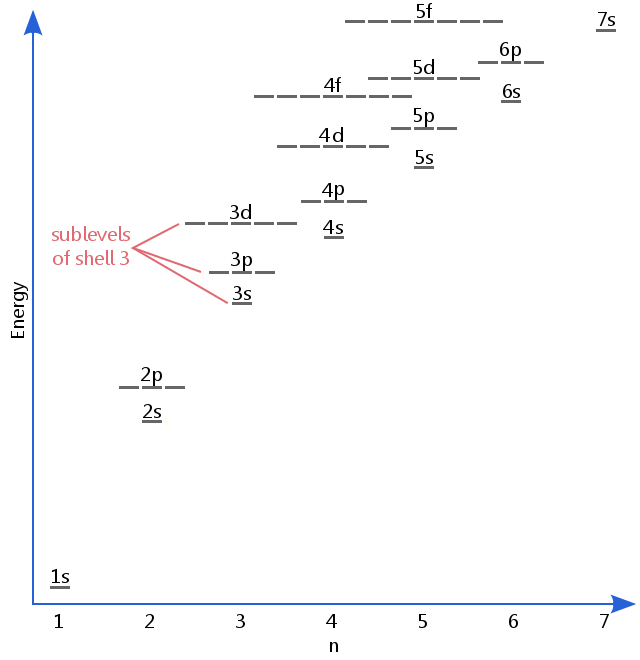

podpoziomy elektronów są znane za pomocą liter S, P, D i f.So na przykład, elektrony na podpoziomie s powłoki 3 mają inną ilość energii od elektronów na poziomach P I d powłoki 3.(Tak nie jest w przypadku wodoru., Wszystkie podpoziomy wodoru mają tę samą energię, ponieważ Wodór ma tylko jeden elektron.)
podpoziomy s, p, d i f
podpoziom zajmowany przez dowolny elektron jest określony przez liczbę kwantową momentu pędu elektronu, l.,div id=”7de4153d3c”>
The energy level diagram excerpt below shows the sublevels corresponding to different values of l in the fourth electron shell.,
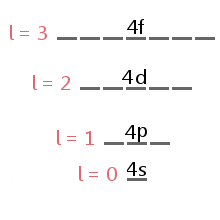
orbitale Podpoziomowe mają charakterystyczne kształty, które można wykorzystać do wyjaśnienia i przewidywania wiązań chemicznych, które mogą tworzyć Atomy.Te kształty są oparte na prawdopodobieństwie znalezienia elektronu w dowolnym miejscu orbitującym wokół jądra.
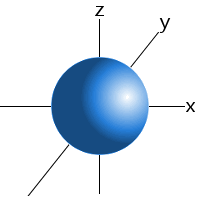
na przykład, możemy powiedzieć, że elektron w atomie wodoru 1s sublevel znajdzie 99 procent czasu gdzieś w kuli o określonym promieniu wokół jądra.Z tego powodu możemy narysować orbitale podpoziomu s jako sferę.,
orbitale dla wyższych podpoziomów są również rysowane na podstawie miejsca, w którym elektrony atomu są najbardziej prawdopodobne. Zobacz orbitale po więcej szczegółów.
orbital podpoziomu s
przykłady podpoziomów
przykłady podpoziomów znalezionych w różnych atomach są pokazane poniżej. Indeks górny pokazuje liczbę elektronów w każdym podpoziomie.
Wodór: 1S1
węgiel: 1S2 2s2 2P2
chlor: 1S2 2s2 2p6 3S2 3P5
Argon: 1S2 2S2 2p6 3S2 3P6
ogólnie rzecz biorąc, elektrony przechodzą na najniższy dostępny podpoziom energii., Ogólna kolejność wypełniania podpoziomów to:
1s 2s 2P 3s 3p 4s 3D 4P 5s 4d 5p 6s 4F 5d 6P 7s 5F 6D 7p
biorąc to pod uwagę, możemy odpowiedzieć na pytania typu: „jakie są podpoziomy elektronów potasu?”
potas ma 19 elektronów, a wiemy, że orbitale s posiadają maksymalnie dwa elektrony, a p maksymalnie sześć. Podpoziom elektronów potasu będzie:
Dodaj komentarz